We present here the Synopsis of South American Angiosperms (SSAA), a broad text that intends to summarize in a succinct way all the native diversity of angiosperms on South America, including Malvinas as part of Argentina, and excluding southern Panama. This work is structured by order, families, subfamilies/tribes/subtribes (if present), genera, subgenera/clades/sections/subsections/series (if present), with a small entry for each.
1 OUR NUMBERS
In these numbers, we identified in January 21, 2025, exacts 4,151 native genera of angiosperms in South America, 2,746 in Brazil (353 endemics) and 1,405 absent. Largest families in number of genera are Asteraceae (530), Orchidaceae (289), Fabaceae (270), Poaceae (234), Rubiaceae (174), Malvaceae (107), Apocynaceae (103) and Cactaceae (101). Together, these families comprise 1,808 genera in South America, 43,55% of the continent's generic Angiosperm diversity.
The quantity of all Brazilian, non-Brazilian, and endemic genera of Brazil, by family and order, is available in ANNEX 1.
2 INSPIRATION
This text was inspired by THE FAMILIES AND GENERA OF VASCULAR PLANTS, which provided inspiration for the existence of this project and much of the information of genera and families present throughout the text, and the now disabled website Neotropikey from Kew.
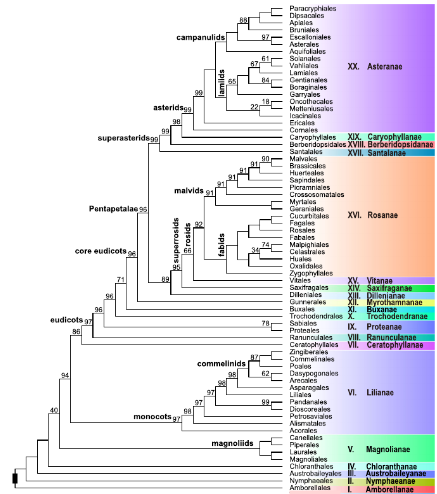
3 ORDER AND FAMILY CLASSIFICATION
The initial list of families by order was drawn up following APG: ANGIOSPERMS PHYLOGENY GROUP WEBSITE in real time. Although important works have emancipated Parnassiaceae (Simmons, Lombardi & Biral, Systematic Botany, 2023) from Celastraceae, here we still consider the union, in accordance with the APG Website (SEE).
For the little that it is worth, there are 4 orders and 13 families of gymnosperms characterised on these pages, and together they include some 82 genera and 947 species. For angiosperms, comparable figures are 57 orders, 446 families, 13,208 genera, and 261,750 species (of which monocots include 11 orders, 89 families, 2,759 genera and 52,760 species), in MOBOT (2024, SEE).
4 INFRAFAMILIAR CLASSFICATION
For the internal classification of each family, we primarily follow Angios Bergianska, dated January 2024 (SEE). However, for some families, we follow specific literature published for their internal classification.
Poaceae (Huang, W. et al, Molecular Plant, 2022)
Velloziaceae (Magri, R.A. et al, BJLS, 2024).
Amaryllidaceae (Meerow, A., Boletín de la Sociedad Argentina de Botánica, 2023).
Malpighiaceae (Almeida, R.F. et al, PhytoKeys, 2024).
Malvaceae (Colli-Silva et al, Taxon, 2024).
Cleomaceae (Saunders, T.C. et al., American Journal of Botany, 2024).
Rubiaceae (Razafimandimbison & Rydin, Taxon, 2024).
5 REFERENCES USED BY FAMILY
Capparaceae and Cleomaceae follows exclusively notes made in ANNEX 2 for these families, and we rejected POWO: PLANTS OF THE WORLD ONLINE circunscriptions for this both families.
For remaining 282 out of the 284 native families in South America, we consider the POWO: PLANTS OF THE WORLD ONLINE circumscription in revisions made between June 2024 and January 21, 2025, accepted here in full plus specific comments made on the first review date of each individual family (mainly for June to December 2024), all listed in ANNEX 2 for this work, and posterior sazonal updates, listed in ANNEX 3.
6 DATA AWAITING ANALYSIS
For news not yet analyzed, see ANNEX 4.
7 SYMBOLOGY
- BLACK genera refer to Brazilian non endemic genera.
- BROWN genera refer to Brazilian absent genera.
- BLUE genera refer to Brazilian endemic genera.
8 SEE ALSO
SIDERASIS ANGIOSPERMS, which, in conjunction with this work, provides a large amount of information, with emphasis on infrafamilial and infregeneric notes, in addition to the excellent explanation of morphological and ecological notes.
...
ANNEX 1: ANGIOSPERMS TABLES
Here is a list of all the APG families and orders in January 21, 2025, with the number of Brazilian, unbrazilian and Brazilian endemic genera in each one, as part of project Synopsis of South American Angiosperms.
WHITE LINES: families/orders that occur native in Brazil.
ORCHID PINK LINES: exxofamilies/exxorders.
GRAY LINES: groups totally absent in South America.
BY FAMILY
FAMILY
BRAZILIAN GENERA
UNBRAZILIAN GENERA
BRAZILIAN ENDEMIC GENERA
AMBORELLACEAE
HYDATELLACEAE
CABOMBACEAE
1
1
NYMPHAEACEAE
2
AUSTROBAILEYACEAE
TRIMENIACEAE
SCHISANDRACEAE
CANELLACEAE
1
1
WINTERACEAE
1
SAURURACEAE
PIPERACEAE
3
ARISTOLOCHIACEAE
1
1
HYDNORACEAE
1
MYRISTICACEAE
5
MAGNOLIACEAE
1
DEGENERIACEAE
HIMANTANDRACEAE
EUPOMATIACEAE
ANNONACEAE
29
2
3
CALYCANTHACEAE
SIPARUNACEAE
1
GOMORTEGACEAE
1
ATHEROSPERMATACEAE
1
HERNANDIACEAE
3
MONIMIACEAE
5
2
3
LAURACEAE
24
3
3
CHLORANTHACEAE
1
ARACEAE
38
10
7
TOFIELDIACEAE
1
ALISMATACEAE
5
1
BUTOMACEAE
HYDROCHARITACEAE
5
1
SCHEUCHZERIACEAE
MAUNDIACEAE
APONOGETONACEAE
JUNCAGINACEAE
1
1
ZOSTERACEAE
1
POTAMOGETONACEAE
3
POSIDONIACEAE
RUPPIACEAE
1
CYMODOCEACEAE
1
1
ACORACEAE
PETROSAVIACEAE
NARTHECIACEAE
1
BURMANNIACEAE
7
THISMIACEAE
1
1
AFROTHISMIACEAE
TACCACEAE
1
DIOSCOREACEAE
1
TRIURIDACEAE
5
1
VELLOZIACEAE
2
1
STEMONACEAE
CYCLANTHACEAE
9
2
PANDANACEAE
CAMPYNEMATACEAE
MELANTHIACEAE
1
PETERMANNIACEAE
ALSTROEMERIACEAE
2
1
COLCHICACEAE
PHILESIACEAE
2
RIPOGONACEAE
SMILACACEAE
1
CORSIACEAE
1
LILIACEAE
ORCHIDACEAE
175
114
24
BORYACEAE
BLANDFORDIACEAE
ASTELIACEAE
1
LANARIACEAE
HYPOXIDACEAE
2
TECOPHILAEACEAE
3
DORYANTHACEAE
IXIOLIRIACEAE
IRIDACEAE
17
8
3
XERONEMATACEAE
ASPHODELACEAE
1
1
AMARYLLIDACEAE
10
27
3
ASPARAGACEAE
6
7
ARECACEAE
36
16
1
DASYPOGONACEAE
HANGUANACEAE
COMMELINACEAE
14
2
1
PHILYDRACEAE
PONTEDERIACEAE
2
HAEMODORACEAE
2
1
TYPHACEAE
1
1
BROMELIACEAE
57
11
28
RAPATEACEAE
9
7
XYRIDACEAE
4
1
ERIOCAULACEAE
15
3
MAYACACEAE
1
THURNIACEAE
1
JUNCACEAE
6
6
CYPERACEAE
32
9
RESTIONACEAE
2
FLAGELLARIACEAE
JOINVILLEACEAE
ECDEIOCOLEACEAE
POACEAE
178
60
23
STRELITZIACEAE
1
LOWIACEAE
HELICONIACEAE
1
MUSACEAE
CANNACEAE
1
MARANTACEAE
10
1
COSTACEAE
3
1
ZINGIBERACEAE
1
CERATOPHYLLACEAE
1
EUPTELEACEAE
PAPAVERACEAE
2
CIRCAEASTERACEAE
LARDIZABALACEAE
2
MENISPERMACEAE
16
1
BERBERIDACEAE
1
RANUNCULACEAE
4
6
SABIACEAE
2
NELUMBONACEAE
1
PLATANACEAE
PROTEACEAE
3
5
TROCHODENDRACEAE
BUXACEAE
1
1
MYROTHAMNACEAE
GUNNERACEAE
1
DILLENIACEAE
6
PERIDISCACEAE
1
1
PAEONIACEAE
ALTINGIACEAE
HAMAMELIDACEAE
1
CERCIDIPHYLLACEAE
DAPHNIPHYLLACEAE
ITEACEAE
GROSSULARIACEAE
1
SAXIFRAGACEAE
4
CRASSULACEAE
1
1
APHANOPETALACEAE
TETRACARPAEACEAE
PENTHORACEAE
HALORAGACEAE
3
1
CYNOMORIACEAE
VITACEAE
3
1
KRAMERIACEAE
1
ZYGOPHYLLEACEAE
2
9
QUILLAJACEAE
1
FABACEAE
212
58
22
SURIANACEAE
1
POLYGALACEAE
11
4
1
ROSACEAE
6
5
BARBEYACEAE
DIRACHMACEAE
ELAEAGNACEAE
RHAMNACEAE
13
10
2
ULMACEAE
2
CANNABACEAE
2
1
MORACEAE
18
2
URTICACEAE
13
1
NOTHOFAGACEAE
3
FAGACEAE
2
MYRICACEAE
1
JUGLANDACEAE
3
CASUARINACEAE
TICODENDRACEAE
BETULACEAE
1
ANISOPHYLLEACEAE
2
CORYNOCARPACEAE
CORIARIACEAE
1
CUCURBITACEAE
21
6
2
TETRAMELACEAE
DATISCACEAE
BEGONIACEAE
1
LEPIDOBOTRYACEAE
1
CELASTRACEAE
22
2
2
HUACEAE
CONNARACEAE
5
1
OXALIDACEAE
2
CUNONIACEAE
2
2
ELAEOCARPACEAE
2
2
CEPHALOTACEAE
BRUNELLIACEAE
1
PANDACEAE
RHIZOPHORACEAE
4
ERYTHROXYLACEAE
1
PERACEAE
3
APODANTHACEAE
2
RAFFLESIACEAE
EUPHORBIACEAE
64
10
4
CENTROPLACACEAE
CTENOLOPHONACEAE
OCHNACEAE
17
2
1
PICRODENDRACEAE
2
1
PHYLLANTHACEAE
16
5
2
ELATINACEAE
2
MALPIGHIACEAE
44
6
4
BALANOPACEAE
TRIGONIACEAE
2
1
1
DICHAPETALACEAE
3
EUPHRONIACEAE
1
CHRYSOBALANACEAE
13
1
LOPHOPYXIDACEAE
PUTRANJIVACEAE
1
PASSIFLORACEAE
7
2
LACISTEMATACEAE
2
SALICACEAE
16
3
1
VIOLACEAE
11
1
1
GOUPIACEAE
1
ACHARIACEAE
4
1
CARYOCARACEAE
2
HUMIRIACEAE
8
1
IRVINGIACEAE
LINACEAE
3
IXONANTHACEAE
2
CALOPHYLLACEAE
8
1
CLUSIACEAE
10
2
1
BONNETIACEAE
2
PODOSTEMACEAE
14
1
3
HYPERICACEAE
2
GERANIACEAE
2
1
FRANCOACEAE
1
4
COMBRETACEAE
4
LYTHRACEAE
11
2
1
ONAGRACEAE
4
3
VOCHYSIACEAE
6
1
MYRTACEAE
20
8
4
MELASTOMATACEAE
54
26
10
CRYPTERONIACEAE
ALZATEACEAE
1
PENAEACEAE
APHLOIACEAE
GEISSOLOMATACEAE
STRASBURGERIACEAE
STAPHYLEACEAE
1
1
GUAMETALACEAE
STACHYURACEAE
CROSSOSOMATACEAE
PICRAMNIACEAE
3
1
BIEBERSTEINIACEAE
NITRARIACEAE
KIRKIACEAE
BURSERACEAE
5
ANACARDIACEAE
14
9
1
SAPINDACEAE
26
7
2
RUTACEAE
31
8
4
SIMAROUBACEAE
7
MELIACEAE
6
2
GERRARDINACEAE
PETENAEACEAE
TAPISCIACEAE
1
DIPENTODONTACEAE
1
CYTINACEAE
1
MUNTINGIACEAE
1
2
NEURADACEAE
MALVACEAE
69
33
7
SPHAEROSEPALACEAE
THYMELAEACEAE
7
2
BIXACEAE
2
SARCOLAENACEAE
CISTACEAE
1
1
DIPTEROCARPACEAE
1
AKANIACEAE
TROPAEOLACEAE
1
TIGANOPHYTACEAE
MORINGACEAE
CARICACEAE
2
LIMNANTHACEAE
SETCHELLANTHACEAE
KOEBERLINIACEAE
1
BATACEAE
1
SALVADORACEAE
EMBLINGIACEAE
TOVARIACEAE
1
PENTADIPLANDRACEAE
GYROSTEMONACEAE
RESEDACEAE
CAPPARACEAE
11
8
1
CLEOMACEAE
6
4
1
BRASSICACEAE
4
45
AEXTOXICACEAE
1
BERBERIDOPSIDACEAE
1
BALANOPHORACEAE
6
1
1
OLACACEAE
2
APTANDRACEAE
3
COULACEAE
1
ERYTHROPALACEAE
2
1
STROMBOSIACEAE
1
XIMENIACEAE
3
MYSTROPETALACEAE
OCTOKNEMACEAE
OPILIACEAE
1
SANTALACEAE
7
5
LORANTHACEAE
12
5
1
MISODENDRACEAE
1
SCHOEPFIACEAE
2
1
FRANKENIACEAE
1
TAMARICACEAE
PLUMBAGINACEAE
2
2
POLYGONACEAE
9
5
DROSERACEAE
1
NEPENTHACEAE
MACARTHURIACEAE
KEWACEAE
DROSOPHYLLACEAE
DIONCOPHYLLACEAE
ANCISTROCLADACEAE
RHABDODENDRACEAE
1
SIMMONDSIACEAE
PHYSENACEAE
ASTEROPEIACEAE
CARYOPHYLLACEAE
10
13
ACHATOCARPACEAE
1
AMARANTHACEAE
20
12
4
STEGNOSPERMATACEAE
LIMEACEAE
LOPHIOCARPACEAE
BARBEUIACEAE
GISEKIACEAE
AIZOACEAE
2
2
PETIVERIACEAE
6
2
MICROTEACEAE
1
PHYTOLACCACEAE
1
2
SARCOBATACEAE
NYCTAGINACEAE
9
8
4
MOLLUGINACEAE
2
2
MONTIACEAE
7
DIDIEREACEAE
BASELLACEAE
1
2
HALOPHYTACEAE
1
TALINACEAE
1
1
PORTULACACEAE
1
ANACAMPSEROTACEAE
2
CACTACEAE
42
59
15
HYDROSTACHYACEAE
NYSSACEAE
CURTISIACEAE
GRUBBIACEAE
CORNACEAE
1
HYDRANGEACEAE
1
LOASACEAE
5
9
BALSAMINACEAE
MARCGRAVIACEAE
6
1
TETRAMERISTACEAE
1
1
FOUQUIERIACEAE
POLEMONIACEAE
12
LECYTHIDACEAE
10
1
SLADENIACEAE
PENTAPHYLACACEAE
2
1
SAPOTACEAE
22
1
1
EBENACEAE
2
PRIMULACEAE
11
4
THEACEAE
1
SYMPLOCACEAE
1
DIAPENSIACEAE
STYRACACEAE
1
SARRACENIACEAE
1
RORIDULACEAE
ACTINIDIACEAE
1
CLETHRACEAE
1
1
CYRILLACEAE
1
MITRASTEMONACEAE
1
ERICACEAE
14
19
ONCOTHECACEAE
METTENIUSACEAE
4
1
ICACINACEAE
3
EUCOMMIACEAE
GARRYACEAE
RUBIACEAE
123
51
18
GENTIANACEAE
30
15
7
LOGANIACEAE
5
1
GELSEMIACEAE
1
APOCYNACEAE
83
20
7
VAHLIACEAE
EHRETIACEAE
4
4
1
BORAGINACEAE
3
12
HYDROPHYLLACEAE
1
NAMACEAE
2
HELIOTROPIACEAE
3
1
CORDIACEAE
2
CODONACEAE
WELLSTEDIACEAE
CONVOLVULACEAE
20
1
SOLANACEAE
32
30
4
MONTINIACEAE
SPHENOCLEACEAE
HYDROLEACEAE
1
PLOCOSPERMATACEAE
CARLEMANNIACEAE
OLEACEAE
3
2
TETRACHONDRACEAE
2
CALCEOLARIACEAE
1
1
PELTANTHERACEAE
1
GESNERIACEAE
27
32
6
PLANTAGINACEAE
21
13
7
SCROPHULARIACEAE
4
1
STILBACEAE
LINDERNIACEAE
5
2
PEDALIACEAE
LAMIACEAE
39
7
7
PHRYMACEAE
2
PAULOWNIACEAE
MAZACEAE
OROBANCHACEAE
10
5
3
WIGHTIACEAEA
LENTIBULARIACEAE
2
1
ACANTHACEAE
33
13
6
BIGNONIACEAE
29
10
1
THOMANDERSIACEAE
SCHLEGELIACEAE
1
2
VERBENACEAE
14
12
BYBLIDACEAE
MARTYNIACEAE
3
1
1
STEMONURACEAE
1
CARDIOPTERIDACEAE
1
PHYLLONOMACEAE
1
HELWINGIACEAE
AQUIFOLIACEAE
1
ROUSSEACEAE
CAMPANULACEAE
6
5
PENTAPHRAGMATACEAE
STYLIDIACEAE
2
ALSEUOSMIACEAE
PHELLINACEAE
ARGOPHYLLACEAE
MENYANTHACEAE
1
GOODENIACEAE
1
1
CALYCERACEAE
2
6
ASTERACEAE
274
256
73
ESCALLONIACEAE
1
3
COLUMELLIACEAE
2
BRUNIACEAE
PARACRYPHIACEAE
VIBURNACEAE
2
CAPRIFOLIACEAE
1
PENNANTIACEAE
TORRICELLIACEAE
GRISELINIACEAE
1
PITTOSPORACEAE
ARALIACEAE
7
2
MYODOCARPACEAE
APIACEAE
10
27
1
2,746
1,405
354
TOTAL
4,151
BY ORDER
FAMILY
BRAZILIAN GENERA
UNBRAZILIAN GENERA
BRAZILIAN ENDEMIC GENERA
Amborellales
Nymphaeales
3
1
Austrobayleales
Canellales
2
1
Piperales
5
1
Magnoliales
35
2
3
Laurales
33
7
6
Chloranthales
1
Alismatales
55
15
7
Acorales
Petrosaviales
Dioscoreales
11
1
Pandanales
16
4
Liliales
3
5
Asparagales
211
161
30
Arecales
36
16
1
Commelinales
18
3
1
Poales
304
97
54
Zingiberales
17
2
Ceratophyllales
1
Ranunculales
21
10
1
Proteales
5
6
Trochodendrales
Buxales
1
1
Gunnerales
1
Dilleniales
6
Saxifragales
5
9
Vitales
3
1
Zygophyllales
3
9
Fabales
225
62
23
Rosales
54
19
2
Fagales
10
Cucurbitales
24
7
2
Celastrales
23
2
2
Oxalidales
12
4
1
Malpighiales
267
37
20
Geraniales
3
5
Myrtales
99
41
15
Crossossomatales
1
1
Picramniales
3
1
Sapindales
89
26
7
Huertales
2
Malvales
80
40
7
Brassicales
25
59
2
Berberidopsidales
2
Santalales
40
14
2
Caryophyllales
110
121
23
Cornales
5
11
Ericales
74
43
1
Metteniusales
4
1
Oncothecales
Icacinales
3
Garryales
Gentianales
242
86
32
Vahliales
Boraginales
13
19
1
Solanales
53
30
5
Lamiales
192
105
33
Aquifoliales
1
1
Cardiopteridales
2
Asterales
284
270
73
Escalloniales
1
3
Desfontainiales
2
Bruniales
Paracryphyales
Dipsacales
3
Apiales
18
29
1
2,746
1,405
354
TOTAL
4,151
ANNEX 2: ADDITIONAL REFERENCES ON THE DATE OF THE GENERAL REVIEW VIA POWO
We highlight here the different considerations made for the construction of the text, organized phylogenetically by order and family, according to the revision date of each one.
NYMPHAEALES
CABOMBACEAE
For Brasenia schreberi J.F.Gmel., we followed R. Acuña-Castillo et al. (Darwiniana, 2021), which details its distribution in the Neotropics, with several records absent from the POWO on as of June 11, 2024.
NYMPHAEACEAE
For Victoria Lindl., we follow T. Smith et al. (Frontiers in Plant Science, 2022), due to the extreme richness of details, maps, and analyses, which are more precise than the data in POWO on as of June 11, 2024.
MAGNOLIALES
MYRISTICACEAE
POWO on as of June 12, 2024 considers the genus Bicuiba J.J. de Wilde, endemic to Brazil, to be valid, but here it is rejected based on the arguments of Rodrigues, W.A. (Acta Botanica Brasilica, 1998), and is thus reduced to a synonym of Virola Aubl.
Here, we count Compsoneura choibo Villanueva & Cogollo (Colombia, 2024), absent in POWO on as of June 12, 2024.
MAGNOLIACEAE
For Magnolia L. in Brazil, we follo J.C.J. et al. (Phytotaxa, 2024), who records 5 spp., differing from POWO on as of June 11, 2024, by excluding M. paranaensis A.Vázquez.
ANNONACEAE
Here, we count the synonymization of Stenanoma Standl. within Desmopsis Saff., reducing the total in South America (viz. Colombia) by one genus, via Schats, E. et al. (Novon, 2023).
For Honschuchia Nees., we follow the global revision of the genus by Vilela L. & de Carvalho Lopes J. (European Journal of Taxonomy, 2022), which recognizes 14 species, two more than the POWO on as of June 12, 2024.
Here, we count Oxandra cerradensis Ferreira & D.O.Diniz (Brazil, 2024) as an additional species, absent in POWO on as of June 12, 2024.
LAURALES
LAURACEAE
Here, we consider Dicypellium anisum F.M.Alves & Zappi, endemic to Brazil but absent in POWO as of June 12, 2024.
Here, we consider Aniba brochidodroma van der Werff, A. glabra van der Werff, A. palaciosii van der Werff, A. tomentella van der Werff, A. verticillata van der Werff, from Colombia, Ecuador and Peru (2023), all absent in POWO as of June 12, 2024.
MONIMIACEAE
Here we include Mollinedia lorencei Borges-Lima, Zavatin & Lírio (Monimiaceae, BR, 2024), a species absent in POWO in as of June 12, 2024.
PIPERALES
ARISTOLOCHIACEAE
The definitions within Aristolochiaceae vary considerably depending on the reference used. In particular, the validity of the genera Isotrema Raf. and Euglypha Chodat & Hassl. is a significant issue. POWO invalidates the former and validates the latter. However, here we take the opposite approach: we validate Isotrema based on Ma et al. (Phytotaxa, 2019) and synonymize Euglypha under Aristolochia L. The numbers for Isotrema are 98 species, with 17 in the New World: 5 in the USA, 4 endemic to Mexico, 3 ranging from Mexico to America Central, 2 endemic to Guatemala, and one endemic each to Nicaragua, El Salvador, and Panama.
Here we adopt a geographical distribution for Prosopanche americana (R. Br.) Kuntze that differs from the one proposed by POWO, based on Hatt, S.A. et al. (Plants People Planet, 2022).
Here we consider Aristolochia goudotii Duch. to also be present in Brazil, based on Fernandes, J.M. et al. (Research Society and Development, 2021).
PIPERACEAE
For Manekia Trelease, POWO on as of June 12, 2024 recognizes 6 spp., but here, following Schubert et al. (Systematic Botany, 2012), 3 of them are synonymized under M. incurva (Sieber ex Schult.) T. Arias, Callejas & Bornst., while the remaining two are retained.
Here we consider Peperomia pereirae Yunck under P. rubricaulis (Nees) A. Dietr., P. pereirae f. hirtulicaule Yunck as a synonym of P. hirtulicaulis (Yunck.) Marcusso (Marcusso et al., Phytotaxa, 2024), and a new species: Piper alwynii Callejas & Betancur (Peru and Ecuador, 2023).
ALISMATALES
ARACEAE
For Lemnoideae, we exclusively follow the circumscription proposed by Bog, Appenroot & Sree (Nordic Journal of Botany, 2020), which differs significantly from that presented in POWO on July 5, 2024.
The following described species are not listed in POWO as of July 5, 2024, and are not yet included here: Stenospermation albifolium Castaño-Rubiano, S. melidae Castaño-Rubiano & Sierra-Giraldo, S. selvaflorensis Castaño-Rubiano, L. Ibañez & A. Zuluaga (Colombia, 2023), Anthurium dairon-cardenasii López-Flor., Croat & Marco Correa (Colombia, 2024), Anthurium bellissimum K.M. Pimenta & Mayo and A. itacarense K.M. Pimenta & Mayo (Brazil, 2024).
Here we recognize Thaumatophyllum Schott. via Sakuragui, C.M. et al (PhytoKeys, 2018), with 21 species, all South American, 19 in Brazil, 13 endemic. POWO on July 5, 2024, synonymizes it under Philodendron Schott. (SEE).
POWO on July 5, 2024, distributes Asterostigma luridum (Kunth) Kuntze to Argentina and Brazil (SEE). Here we follow Reflora, which synonymizes this species under A. lividum (Lodd.) Engl. and treats it as endemic to Brazil (SEE), making the genus entirely Brazilian.
TOFIELDIACEAE
As of June 14, 2024, POWO recognizes only two Harperocallis McDaniel species in Brazil, but here we recognize two additional species: H. neblinae (Steyerm. ex L.M.Campb.) L.M.Campb. & Dorr and H. penduliflora (L.M.Campb.) L.M.Campb. & Dorr, according to the List of Terrestrial Plant Species of the Pico da Neblina National Park, totaling four species in the country, one endemic. Additionally, H. schomburgkiana (Oliv.) L.M. Campb. & Dorr is cited in Roraima, via Reflora/Virtual Herbarium.
HYDROCHARITACEAE
POWO on as of June 22, 2024, does not consider Halophila decipiens Ostenf. in Brazil (SEE), but here we consider it based on many public sources, particularly Barros, K. et al. (Feddes Repertorium, 2015) and Reflora (SEE).
JUNCAGINACEAE
As of June 22, 2024, POWO, does not consider the species Triglochin scilloides (Poir.) Mering & Kadereit in Brazil (SEE); however, we consider this species present in the country, based on Reflora (SEE).
CYMODOCEACEAE
Despite POWO on as of June 22, 2024, synonymizing Halodule beaudettei (Hartog) Hartog with H. wrightii Asch. (SEE), we consider the species distinct here.
POTAMOGETONACEAE
POWO on as of June 22, 2024, does not recognize Stuckenia Borner in Brazil (SEE); however, here we accept two species in the country, based on Freitas, E.C. (Brazilian Journal of Biology, 2012).
POWO on as of June 22, 2024, does not recognize Zannichellia L. in Brazil (SEE); however, here we accept two species in the country based on Reflora (SEE).
DIOSCOREALES
TACCACEAE
Although POWO on as of June 14, 2024, considers Taccaceae as a synonym of Dioscoreaceae, here we treat it independently based on APG IV.
THISMIACEAE
For Burmanniaceae, here, we follow the APWeb (SEE) here, which separates the genera recognized by POWO on as of June 20, 2024 (SEE) into three groups: Burmanniaceae S.S. (Apteria Nutt., Burmannia L., Campylosiphon Benth., Dictyostega Miers, Gymnosiphon Blume, Hexapterella Urb., Marthella Urb., and Miersiella Urb.), Afrothismiaceae (Afrothismia Schltr.), and Thismiaceae (Haplothismia Airy Shaw, Oxygyne Schltr., Thismia Griff., and Tiputinia P.E.Berry & C.L.Woodw.). Additionally, we include Relictithismia Suetsugu & Tagane, recently described for Kyushu Island in southern Japan (Suetsugu et al., Journal of Plant Research, 2024).
Despite not being published, we count Tiputinia P.E. Berry & C. Woodw. in Peru, based on a photographic record of the genus in southern Peru on iNaturalist (SEE).
Here we recognize the valid status of Thismia caudata Maas & H.Maas as not extinct (rediscovery in 2023), with its distribution extended to southern Brazil (SEE).
Two species listed in POWO on as of June 20, 2024, T. espirito-santensis Brade and T. iguassuensis (Miers) Warm., both from SE Brazil, are provisionally rejected here.
Thismia panamensis (Standl.) Jonker is accepted here as native to Brazil, based on the unequivocal record of its occurrence in Paraná, southern Brazil (Inti de Souza, Checklist, 2021).
Thismia calcarata D. F. Silva, Honorio & J. M. A. Braga is also counted here in Peru, based on the photographic record available on iNaturalist.org (SEE).
BURMANNIACEAE
Here we note the expansion of Campylosiphon Benth. (Li et al., Systematic Botany, 2023), including two species of Burmannia L. from Asia and Africa, and a new Asian species absent from POWO on as of June 20, 2024.
DIOSCOREACEAE
Although, as of June 14, 2024, POWO considers Taccaceae a synonym of Dioscoreaceae, here we treat it independently based on APG IV.
PANDANALES
VELLOZIACEAE
Here we reject Nanuza L.B.Sm. & Ayensu as recognized in POWO on as of June 21, 2024, and consider it synonymized under Vellozia Vand., as in Reflora (SEE).
CYCLANTHACEAE
As of June 21, 2024, POWO recognizes Cyclanthus indivisus R.E. Schult. in addition to C. bipartitus Poit. ex A. Rich. for Panama and Colombia (SEE); however, there are unconfirmed records of the species in Peru (Reflora) and Brazil (Flickr); here we have decided to reject the species and consider only C. bipartitus within the genus.
LILIALES
SMILACACEAE
Here we accept two species absent in POWO on as of June 12, 2024: Smilax brevipedunculata T.Murphy & S.M.Niño (Venezuela to Suriname, 2023) and Smilax tafelbergensis T.Murphy & Molgo (Suriname, 2023).
ASPARAGALES
ORCHIDACEAE
Despite being listed as Brazilian in POWO on January 21, 2025 (SEE), we follow Reflora here and reject Aa Rchb.f. in the country (SEE).
Despite POWO listing Degranvillea Determann as native to Suriname on January 21, 2025 (SEE), we consider it an endemic species of French Guiana due to the lack of conclusive evidence supporting its occurrence in Surinamese territory.
Here, we also recognize Quechua Salazar & L. Jost in Ecuador, based on the original description of the genus in Salazar & L. Jost (Systematic Botany, 2012), a distribution not listed in POWO on January 21, 2025 (SEE).
We are considering here the requalification of Liparis Rich. as native to Brazil, according to Santos, T.F. et al. (Rodriguesia, 2023), with the recognition of three spp., one endemic.
Via Royer et al. (Systematic Botany, 2022), here we accept Dunstervillea Garay under Eloyella P. Ortiz.
Here, we follow J.B.F. da Silva (2010, E-book) to accept Kefersteinia Rchb.f. in Brazil and deeply regret that the record has not yet been formalized in Powo on January 21, 2025.
We are considering the expanded genus Trichocentrum, which now includes Grandiphyllum and Saundersia (Meneguzzo & Chase, Phytotaxa, 2024).
We are considering the requalification of Bifrenaria as an expanded genus, now including the previously accepted genera Guanchezia, Horvatia, Rudolfiella, Scuticaria, and Teuscheria (Meneguzzo & Chase, Phytotaxa, 2024).
POWO states on January 21, 2025, that Scaphosepalum Pfitzer is absent in Brazil; however, we accept two species of this genus in the country, based on Reflora (SEE).
IRIDACEAE
Here, for the tribe Trimezieae, we follow Lovo, J. et al. (Taxon, 2018), which divides the tribe into five genera: Deluciris A.Gil & Lovo, Neomarica Sprague, Pseudiris Chukr & A.Gil, Pseudotrimezia R.C.Foster, and Trimezia Salisb. ex Herb. As of July 7, 2024, POWO recognizes all of them as merged into Trimezia (SEE).
As of July 7, 2024, POWO does not recognize A. drummondii (Graham) R.C.Foster in Brazil (SEE), but we recognize it as present in Brazil based on Reflora (SEE).
ASPARAGACEAE
Furcraea foetida (L.) Haw. is listed by the VPA as absent in Brazil (SEE), and it is a species more commonly associated with ecological invasion rather than being native to Brazil; many sources consider it native, while many others regard it as invasive and exotic. As of June 23, 2024, POWO lists another species, F. stricta Jacobi, as native, and from the Northeast (SEE). Here we have decided to adopt the species F. foetida as native based on our own interpretation of Barbosa (Thesis, 2017, p. 54), but cited as native only to state of Amapá.
Dracaena Vand. ex L. is confirmed in South America (a single record in Colombia) by Zona et al. (Vieraea Folia Scientiarum Biologicarum, 2014), as in POWO on as of June 23, 2024.
POALES
BROMELIACEAE
POWO on July 4, 2024, does not recognize Connelia N.E.Br. in Brazil (SEE). Here, we consider four of the six species in Brazilian territory, based on Reflora (SEE).
Lutheria Barfuss & W. Till. is cited here for Brazil due to collection records in Pará via Reflora (SEE), as well as records from the Summit Post website (SEE), in Roraima, in Raposa Serra do Sol. In POWO on July 4, 2024, this genus is not cited for Brazil (SEE).
Here, we treat Encholirium Mart. ex. Schult. f. and Deuterocohnia Mez. as synonyms under Dyckia Schult., based on J. Gomes-da-Silva et al. (Systematic and Biodiversity, 2019). In POWO on July 4, 2024, the three genera are treated as independent (SEE).
POWO on July 4, 2024, recognizes two Neoregelia L.B.Sm. species absent in Brazil, one in Peru and the other in Venezuela (SEE). Leme et al. (Phytotaxa, 2021) also cites these species but highlights that neither has been collected beyond the type specimen, the Venezuelan species is uncertain, and the distribution pattern for both is unusual. Here, we reject these two species, considering Neoregelia and its 114 species as exclusively Brazilian.
Here we recognize the following species of Bromeliaceae, all absent in POWO on July 4, 2024: Stigmatodon medeirosii D.R. Couto & Gonella (Brazil, 2024), Vriesea organensis Kessous & A.F.Costa (Brazil, 2024), Bromelia longipedicellata H. Luther ex R.F. Monteiro & Forzza and B. stellata H. Luther ex R.F. Monteiro & Forzza (Brazil, 2023).
RAPATEACEAE
On June 26, 2024, Epidryos Maguire was not highlighted in Brazil (SEE) by POWO, but we do so via Rodrigues & Flores (Scientific Note, 2010).
ERIOCAULACEAE
On June 26, 2024, POWO recognizes a moderate and broad circumscription of Paepalanthus Mart. (SEE). Here we follow the taxonomy proposed by Andrini, C.O. et al. (Taxon, 2023), which separates segregates Actinocephalus (Körn.) Sano, Cora Andrino & Sano, Cryptanthella (Suess.) Andrino, Floralia Andrino & F.N.Costa, Giuliettia Andrino & Sano, Gnomus Andrino & Sano, Hydriade Andrino, Lachnocaulon Kunth, Monosperma (Hensold) Andrino, Nisius Andrino and Tonina Aubl. from this genus, none of which are recognized in POWO. The numbers for Paepalanthus Clade followed here are from Andrino et al. (2023), supplemented by the following observations.
Here we recognize the following species absent in Andrini et al. (2023): Paepalanthus avacanoeiro Trovó & R. Silva-Oliveira and P. burle-marxii Trovó (Brazil, 2024).
Here we recognize the following inclusions or synonymizations absent in Andrini et al. (2023): Paepalanthus macrocephalus (Bong.) Körn. under P. argyropus Silveira (Brazil, 2021, SEE), P. petraeus Echtern. under P. uai Andrino, F.N.Costa & Sano (Brazil, 2021, SEE), and P. minimus Silveira as Giuliettia minima (Silveira) Andrino, L. H. Rocha & Gonella (Brazil, 2024, SEE).
JUNCACEAE
On June 26, 2024, POWO recognizes a broad and classical circumscription of Juncus L. (SEE). Here, we follow Záv.Drábk. & Proków (Phytotaxa, 2023) and recognize a fragmentation of the genus. An analysis of POWO data on that date allowed the allocation of 38 out of 40 species from South America into into seven valid genera for this work, except for J. biflorus Elliott and J. magellanicus Lam. These two species were kept under Juncus. The global distributions of each were omitted, keeping only the placements concerning South America. The numbers for Juncus worldwide are treated as those of POWO on as of June 26, 2024 (341), minus the numbers highlighted in Agathryon (Raf.) Záv.Drábk. & Proćków, Alpinojuncus Záv.Drábk. & Proćków, Australojuncus Záv.Drábk. & Proćków, Boreojuncus Záv.Drábk. & Proćków, Juncinella Fourr. (17 spp., 7 already recognized in POWO + 10 non-synonymized species, counted here), Marsippospermum Desv., Rostkovia Desv., and Verojuncus Záv.Drábk. & Proćków (252), all of which are considered independent here.
Agathryon effusum (L.) Záv.Drábk. & Proćków (former Juncus effusus L.) is considered native to Brazil here, based on Reflora (SEE), besides POWO on as of June 26, 2024.
CYPERACEAE
POWO, on November 27, 2024, does not recognize Oreobolus R.Br in Brazil, but here we follow Alves, M. et al. (Rodriguesia, 2019), and validate its occurrence in the dunes of Bahia.
Here, we accept three species absent in POWO on as of June 12, 2024: Cyperus prophyllatus A.R.O.Ribeiro, Pereira-Silva & M.Alves (Brazil, 2021), Rhynchospora parecisensis K. Alves, W.W. Thomas & A. Gil (Brazil, 2023), R. waytii Silva Filho & P.Weber (Brazil and Argentina, 2023), R. barbosae W.W.Thomas, R. hamadryadis W.W.Thomas, and R. eremica W.W.Thomas (Brazil, 2024).
POACEAE
Here, we reject the occurrence of Tibisia farcta (Aubl.) C.D.Tyrrell in French Guiana, as suggested by POWO on January 21, 2025 (SEE), based on the comprehensive revision of the genus (Taxon, 2018).
Following Carvalho & Oliveira (Taxon, 2014), Reitzia Swallen is considered here under Piresia Swallen, although POWO recognizes it as independent as of January 21, 2025 (SEE).
As well stated by Ana M. Cialdella et al. (Cladistics, 2010), and in contrast with POWO on January 21, 2025 (SEE), Stipa L. does not occur in South America. Given the significant inaccuracies, we treat the 26 species that POWO assigns to Stipa under the genus Anatherostipa (Peñailillo, Gayana, 1996). Due to the absence of Lorenzochloa Reeder & C. Reeder (recognized on January 21, 2025, SEE) in the mentioned article, we consider it synonymized under Ortachne Nees ex Steud.
POWO, as of January 21, 2025, recognizes Microbriza Parodi ex Nicora & Rúgolo with two species, both endemic (SEE). Here, we follow N. Silva et al. (Journal of Systematic and Evolution, 2021), who reduced the genus to a single species (with the other being transferred to Poidium Nees), which is not endemic, based on Reflora (SEE).
Cited in POWO on January 21, 2025, as independent genera, we consider Megalachne Stued. and Podophorus Phil. as synonyms of Festuca L., following Tkach et al. (Taxon, 2020).
POWO on January 21, 2025, declares Deschampsia (L.) P. Beauv. as introduced in Brazil (with D. cespitosa (L.) P.Beauv., SEE). However, its native status is strongly accepted based on various sources, including photographic records of populations in the species' occurrence region in the south of the country (iNaturalist).
Cyphonanthus discrepans (Döll) Zuloaga & Morrone is treated as absent in Brazil as of January 21, 2025 (SEE) and as endemic to Brazil in Reflora (SEE). Here, we take a middle-ground approach: native but not endemic to Brazil.
Microchloa kunthii Desv. is not treated as native to Brazil in POWO as of January 21, 2025 (SEE), but here we consider its occurrence valid based on Reflora/Microchloa kunthii (SEE).
COMMELINALES
COMMELINACEAE
Here we consider Buforrestia C.B.Clarke native to Brazil (Reflora), although POWO on as of June 22, 2024, restricts the genus in the New World to Suriname and French Guiana (SEE).
ZINGIBERALES
MARANTACEAE
Here we follow Fernandes, G.C. et al. (Botanical Journal of the Linnean Society, 2023), who synonymizes Myrosma L.f. under Maranta L., a position different from POWO on as of June 21, 2024 (SEE).
Although not South American, here we highlight Sanblasia L. Andersson as included in Calathea G. Mey by Borchsenius, F. et al. (Systematic Botany, 2012), a genus still cited in POWO on as of June 21, 2024. With this inclusion, all New World genera occur in South America.
Here we accept Maranta bambusa F.Fraga (Nordic Journal of Botany, 2024), a species absent from POWO on as of June 21, 2024.
COSTACEAE
POWO on as of June 21, 2024, does not consider Dimerocostus Kuntze as native to Brazil (SEE); however, we accept the occurrence of the species D. strobilaceus Kuntze in the form D. strobilaceus subsp. gutierrezii (POWO), treated as D. gutierrezii Kuntze by Reflora (SEE).
CERATOPHYLLALES
CERATOPHYLLACEAE
SSAA fully follows B. Szalontai et al. (Botanical Journal of the Linnean Society, 2018), which reduces Ceratophyllaceae to 6 species, of which only C. demersum L. and C. australe Griseb. occur in South America, both in Brazil. This circumscription of the group contrasts with classic references (e.g., VPA), making Ceratophyllales perhaps the most disproportionately distributed order in terms of its members' distribution. Compared to Flora 2020, the only difference is that there C. australe is still given as C. muricatum subsp. australe (Griseb.) D.H. Les (SEE).
RANUNCULALES
MENISPERMACEAE
Here, we follow L. Lian et al. (Molecular Phylogenetics and Evolution, 2019), who merged Orthomene Barneby & Krukoff into Anomospermum Miers, a merger not considered in as of POWO on as of June 12, 2024.
BUXALES
BUXACEAE
For Brazil, we accept reports that have not yet been properly published (e.g., Contil Net Notícias), regarding the presence of Styloceras brokawii A.Gentry & R.Foster (Buxaceae) in Brazil, collected in Acre, representing a new record for the species, genus, family, and order in the country.
SAXIFRAGALES
PERIDISCACEAE
Here, we also record Peridiscus Benth. in Colombia, based on Aymard & Arellano (Harvard Papers in Botany, 2018), a record absent in POWO on as of June 10, 2024.
CRASSULACEAE
Despite as of POWO on as of June 10, 2024 recognizing Crassula viridis (S.Watson) M.Bywater & Wickens as native to North America and disjunct in Brazil, we reject the Brazilian occurrence of this species and accept only one species in the country, C. peduncularis (Sm.) Cambess, based on Reflora (SEE) and Giuffre, P.M.W. (Dissertation, 2019).
Here we consider the work of Messerschmid et al. (Taxon, 2020), which outlined the entire classification of the subfamily Sempervivoideae, reducing the tribe Sedeae to a single genus, Sedum L., encompassing Chaloupkaea, Pistorinia, Rosularia, Prometheum, Afrovivella, Dudleya, Chazaroa, Jeronimoa, Quetzalcoatlia, Cremnophila, Echeveria, Graptopetalum, Lenophyllum, Pachyphytum, Thompsonella, and Villadia, and excluding 8 species that migrate to the tribe Aeonieae. According to POWO numbers on as of June 10, 2024, Sedum reaches 861 spp., and the entire family totals 23 genera and 1,667 spp.
SAXIFRAGACEAE
The situation of Saxifragella Engl. is extremely confusing and ambiguous. Deng et al. (Molecular Phylogenetics and Evolution, 2014) consider it natural to include this genus in Saxifraga L. Folk et al. (Taxon, 2021) highlight much indecision on this matter. In light of this, we follow POWO on as of June 10, 2024, validating the inclusion of Saxifragella within Saxifraga.
POWO on as of June 10, 2024 lists Chrysosplenium aulacocarpum Ernst for NE Colombia and NW Venezuela; however, this species is rejected here due to the very limited information available about it.
ZYGOPHYLLALES
ZYGOPHYLLACEAE
Despite POWO on as of June 10, 2024 listing Fagonia Tourn. under Zygophyllum L. and Izozogia G.Navarro under Guaiacum Plum. ex L., here we consider both as independent.
Here we account the wider distribution of Kallstroemia Scop. (Zygophyllaceae) in Brazil, with records in the NE region, Espírito Santo and Rio de Janeiro (Amorim & Santos, PRE-PRINT, 2023).
Kallstroemia maxima (L.) Hook. & Arn. is here rejected in Brazil by Silva, U.C.S. et al. (Periódicos UEFS, 2014); all Kalstroemia records in Brazil belongs K. tribuloides (Mart.) Steud., despites some visual records, as in iNaturalist (VER).
OXALIDALES
CONNARACEAE
Here we accept Bernardinia Planch as valid, while POWO on as of June 21, 2024, synonymizes it with Rourea Aubl. (SEE).
Here we include the species Rourea diamantina C. Toledo (PhytoKeys, 2020), absent from the POWO list on as of June 21, 2024.
BRUNELLIACEAE
Here we take Brunelliaceae present in Brazil. The only accurate information about the family in the country is the description of B. neblinensis Steyerm. & Cuatrec. (Steyermark, Annals of the Missouri Botanical Garden, 1987), which cites a collection on Mount Neblina, at 1,500m altitude, without specifying which side of the mountain. Due to the extreme possibility that the species really only occur on the Brazilian side, we maintain the inclusion. POWO on as of June 21, 2024 does not recognize the species in Brazil (SEE).
CELASTRALES
LEPIDOBOTRYACEAE
Ruptiliocarpon Hammel & N.Zamora is accepted as occurring in Brazil through recent herbarium records from Reflora (SEE); additionally, following the species description by Hammel & Zamora (Novon, 1993), it is also considered here as occurring in Peru and Suriname. These records are absents in POWO on as of June 20, 2024.
CELASTRACEAE
Here we recognize Zinowiewia Turcz. in Brazil, via Biral & Lombardi (Harvard Papers in Botany, 2017), collected in Roraima, a generic record absent in POWO on as of June 20, 2024.
POWO on as of June 20, 2024 treats Monteverdia A. Rich. under Maytenus L. (SEE), but we follow Biral et al. (Systematic Botany, 2017) and consider them distinctly. Thus, we adhere to the VPA numbers as of June 20, 2024, but in this context, we treat Tricerma Liebm from VPA (SEE) under Monteverdia, aligning with POWO's suggested inclusion on the aforementioned date (SEE).
Mystroxylon Eckl. & Zeyh. is rejected in South America due to an error in POWO on as of June 20, 2024, which mistakenly lists a species from the Comoros Islands as Colombian.
Here we consider Haydenoxylon M. P. Simmons as also native to Brazil, a distribution absent in POWO on as of June 20, 2024 (SEE), based on Reflora (SEE).
Salacia coronata N.Hallé, a African species cited for Colombia in POWO on as of June 20, 2024 (SEE), is rejected here.
MALPIGHIALES
Following Alzate J.F. et al. (Molecular Phylogenetics and Evolution, 2024), here we treat Apodanthaceae as part of Malpighiales, on November 8, 2024. The APG IV, on this date, still placed the first family in Cucurbitales.
RHIZOPHORACEAE
Although the revision of Paradrypetes Kuhlm. by A. Levin (Systematic Botany, 1992) describes this genus as endemic to Brazil, and various subsequent works, including POWO on as of June 29, 2024, the VPA also lists it as native to Ecuador (P. subintegrifolia G.A. Levin), collected in the Napo region (SEE), and this is followed here.
OCHNACEAE
Here we follow the requalification of Rhytidanthera (Planch.) Tieghem (Ochnaceae), based on Ladino (Thesys, 2018). POWO, as of November 8, 2024, considers the genus with only two species, both endemic to Colombia (SEE).
The book Plantas Raras do Brasil (UEFS) lists Froesia crassiflora Pires & Fróes and Lacunaria umbonata Pires as endemic to Brazil (and rare), a position we accept here. However, POWO, as of November 8, 2024, records these species also in Colombia and French Guiana, respectively (SEE and SEE, respectively).
Here we include the species Ouratea chepelii S.M.Niño, Dorr & Canelón (Harvard Papers in Botany, 2023), absent from the POWO list on November 08, 2024.
CLUSIACEAE
Arawakia L. Marinho was described to accommodate 18 species from the Tovomita weddelliana complex (Marinho et al, Molecular Phylogenetics and Evolution, 2019). POWO, as of November 8, 2024, does not recognize the genus, treating all 18 species as synonyms of Tovomita weddelliana Planch. & Triana (SEE). Here, we continue with the full recognition of Arawakia.
Havetiopsis Planch. & Triana (a single spp., from Venezuela and Peru) and Quapoya Aubl. (4 spp., all in South America, two in Brazil, one endemic) as of November 8, 2024 (together comprising 6 species, mostly from Peru) are here rejected and treated under Clusia L., as per Elvino (THESIS, 2017, p. 29).
Here we count Clusia reginae Paolini-Ruiz (Venezuela, 2024), absent in POWO in November 08, 2024.
HYPERICACEAE
Here we recognize Vismia parviflora Cham. & Schltdl. as synonymous under V. micrantha A.St.-Hil. (Brazil, SEE), an inclusion not accounted for in POWO on as of June 20, 2024.
MALPIGHIACEAE
We follow Almeida, R.F. et al. (PhytoKeys, 2024), who revised the family classification and brought some differences with POWO on December 9, 2024: he synonymized Lophanthera A.Juss. and Andersiodoxa C.Davis & Amorim under Spachea A.Juss., synonymized Dinemagonum A.Juss. under Dinemandra A.Juss. ex Endl. (both Chilean endemics), Henleophytum H. Karst. (endemic to Cuba) under Heladena A.Juss., making the genus disjoint, and emancipated the South American species of Aspicarpa Rich. into Mamedea R.F.Almeida & M.Pell., making the former genus exclusive to North America.
PODOSTEMACEAE
Here we recognize Lophogyne aeruginosa (P.Royen) C.T.Philbrick & C.P.Bove as a valid species (Phytotaxa, 2024). POWO classifies it as a doubtful species as of October 25, 2024 (SEE).
ELATINACEAE
We reject the species Elatine glaziovii Nied., cited in POWO on as of June 30, 2024 (SEE).
PASSIFLORACEAE
Here, we recognize the following species absent in POWO as of October 25, 2024: Piriqueta velutina L.Rocha & Arbo (Brazil, 2024) and Passiflora pitalensis Arrigui-Torres, J.Ocampo & Rosero-Toro (Colombia, 2024).
SALICACEAE
Here we recognize a species absent in POWO as of November 8, 2024: Tetrathylacium nutans Sleumer (re-established, Salicacae, EC, 2019).
VIOLACEAE
Phyllanoa Croizat is placed in Euphorbiaceae by POWO on November 29, 2024 (SEE). Hayden et al. (PAGE, 1996) highlight it as part of Violaceae. The second reference mentions the genus in Euphorbiaceae, although it cites it in Antidesminae, a lineage of Phyllanthaceae. Given these three positions, here we consider the genus to be in Phyllanthaceae.
EUPHORBIACEAE
POWO, as of November 8, 2024, places Chicomendes W.Cordeiro & M.F.Sales in Phyllanthaceae and considers it exclusive to Peru (SEE). Here, we reject this position within the family and accept the genus in Euphorbiaceae, with occurrences in Brazil, according to its original description (SEE).
Here, unlike POWO on November 29, 2024, we recognize Monadelpha L.J.Gillespie & Card.-McTeag., which is completely absent in the searches on the website, based on Lynn J. Gillespie et al. (PhytoKeys, 2020), known for Brazil and Venezuela.
Phyllanoa Croizat is placed in Euphorbiaceae by POWO on November 29, 2024 (SEE). Hayden et al. (PAGE, 1996) highlight it as part of Violaceae. The second reference mentions the genus in Euphorbiaceae, although it cites it in Antidesminae, a lineage of Phyllanthaceae. Given these three positions, here we consider the genus to be in Phyllanthaceae.
Croton lombardianus Croizat is new species in Brazil (Phytotaxa, 2021), formerly endemic to Uruguay, record absent in POWO as of November 29, 2024.
Euphorbia tithymaloides L. is listed as native to Brazil by POWO November 29, 2024 (SEE), but here we follow Jacobo-Arteaga (PLACEVO, 2022), who significantly restricts its distribution.
Here, we recognize the following species absent in POWO as of November 29, 2024: Euphorbia subilsiae Mayfield (Argentina, 2024), Croton maranonensis Riina & Martín-Muñoz (Peru and Ecuador, 2024) and Caperonia itapevae Külkamp (Brazil, 2024).
PHYLLANTHACEAE
Here, Cicca L. (42 spp. in World, 3 in New World and South America, 2 in Brazil, one endemic) and Moeroris Raf. (197 spp. in World, 26 in New World, 8 in South America, 6 in Brazil, one endemic) are recognized as separated from Phyllanthus L. (now almost restricted for New World except by some weed species), according to Bouman et al. (Phytotaxa, 2022).
Here we accept Richeria dressleri Webster in Brazil, based on Reflora (SEE). POWO, as of November 8, 2024, does not consider this species in Brazil (SEE).
POWO, as of November 8, 2024, places Chicomendes W.Cordeiro & M.F.Sales in Phyllanthaceae and considers it exclusive to Peru (SEE). Here, we reject this position within the family and accept the genus in Euphorbiaceae, with occurrences in Brazil, according to its original description (SEE).
Here we recognize Phyllanthus mimicus + P. bolivianus under P. niruri (2023, SEE), and five new species from Brazil: Phyllanthus novofriburgensis, P. pedrosae, Phyllanthus prancei (2024), P. lobatus, P. platystigma (2023).
Phyllanoa Croizat is placed in Euphorbiaceae by POWO on November 29, 2024 (SEE). Hayden et al. (PAGE, 1996) highlight it as part of Violaceae. The second reference mentions the genus in Euphorbiaceae, although it cites it in Antidesminae, a lineage of Phyllanthaceae. Given these three positions, here we consider the genus to be in Phyllanthaceae.
FABALES
QUILLAJACEAE
On June 22, 2024, POWO lists Quillaja brasiliensis (A. St.-Hil. & Tul.) Mart. as occurring in Peru (SEE), but based on its placement on page 408 of K. Kubitzki (vol. IX, 2007), we systematically reject the occurrence of the species (as well as the genus and family) as native to the Andean country.
FABACEAE
Here, we reject the occurrence of the following genera in the New World, as cited in POWO on January 20, 2025: Galega (G. officinalis L., rejected for Uruguay, SEE), Albizia (A. ortegae Britton & Rose in Mexico, SEE, and A. xerophytica J.Linares in America Central, SEE), Caragana (C. arborescens Lam., rejected for Massachussets, SEE), and Codariocalyx (rejected in Puerto Rico, SEE).
Despite the citation of the occurrence of Gliricidia sepium (Jacq.) Kunth in Brazil by POWO on January 20, 2025 (SEE), we reject this occurrence here, based on Reflora (SEE).
Otholobium C.H.Stirt. is a genus with an uncertain status in POWO as of January 20, 2025. Although it is cited as a synonym of Psoralea L (SEE), the New World species have not been included in this second genus. Here, we follow the list presented in the POWO Build Checklist, which recognizes 16 species within the genus Otholobium for the New World, all restricted to the western part of South America and with a unplaced status. With this circumscription, we adopt this genus in the present study.
Here, we follow Guerra, E. et al. (Phytotaxa, 2023) and recognize only the two exclusively Brazilian species of Abarema Pittier. One species cited by POWO on January 20, 2025, for Venezuela and N Brazil (SEE) is fully rejected here.
POLYGALACEAE
For Bredemeyera Willd., here we follow Mota et al. (Systematic Botany, 2023), which lists 12 species for the genus, in contrast to POWO on as of June 22, 2024, which lists 19 (SEE).
Here we reinforce the position of Pastore et al. (Annals of the Missouri Botanical Garden, 2023) and Pastore & al. (Taxon, 2019), in transferring all New World species of Polygala Tourn. ex L. to Senega (DC.) Spach, including the 32 species that POWO still lists under Polygala as of June 22, 2024, all of which are endemic to Mexico.
POWO on as of June 22, 2024 recognizes Ancylotropis B. Eriksen as a distinct genus (SEE), but here we follow Freire-Fierro et al. (Botanical Journal of Linnean Society, 2023) and treat it as a synonym of Monnina Ruiz & Pav.
Here we accepts Monnina salicifolia Ruiz & Pav. and M. smithii Chodat new records in Venezuela, formerly in Colombia to Bolivia (SEE), besides POWO on as of June 22, 2024.
ROSALES
ROSACEAE
Following Lazo & Potter (Systematic Botany, 2021), we adopt a broad version of Acaena Mutis here, synonymizing Margyricarpus Ruiz & Pavon, Polylepis Ruiz & Pavón, and Tetraglochin Poepp. within it, all of which are still considered independent in POWO as of July 7, 2024.
Regarding Agrimonia L., we consider A. villosa Cham. & Schltdl to be present in both Brazil and Argentina (Keller & Kline, Darwiniana, 2008), although POWO as of July 7, 2024, considers it exclusive to Brazil (SEE).
Here we recognize three species from Colombia (2) and Peru (1) that were described in Lachemilla (Focke) Rydb. in 2019 but are treated here in Alchemilla L.: Lachemilla rothmaleriana D.F.Morales-B. & Romol., L. argentea D.F.Morales-B. & Romol. and L. cyanea D.F.Morales-B. & Romol. (PhytoKeys, 2019).
RHAMNACEAE
The four species of Ziziphus L. from the New World in POWO on July 7, 2024, are placed under Sarcomphalus L. via Hauenschild & al (Taxon, 2016), with Z. cotinifolia Reissek and Z. guaranitica Malme synonymized under S. joazeiro (Mart.) Hauenschild, and the other two species remaining unchanged.
CANNABACEAE
Here we recognize Celtis alnifolia (Wedd.) Miq. reestablished, which in POWO on as of June 27, 2024, was synonymized with C. iguanea (Jacq.) Sarg. (Phytotaxa, 2023).
Here we list the Brazilian endemic Celtis atlantica (Acta Botanica Brasilica, 2024), which is absent in POWO as of June 27, 2024.
Here we recognize Sparrea Hunz. & Dottori, a genus cited in POWO on as of June 27, 2024, synonymized under Celtis L., based on Zamengo Souza et al. (Brazilian Journal of Botany, 2020).
MORACEAE
Important changes at the generic level accepted here: the emancipation of Acanthinophyllum Allemão from Clarisia Ruiz & Pav. in Moraceae (Gardner, E.M., Molecular Phylogenetics and Evolution, 2023), change absent in POWO on as of June 27, 2024.
CUCURBITALES
Following Alzate J.F. et al. (Molecular Phylogenetics and Evolution, 2024), here we treat Apodanthaceae as part of Malpighiales, on November 8, 2024. The APG IV, on this date, still placed the first family in Cucurbitales.
CUCURBITACEAE
Different from what is stated in POWO on as of June 17, 2024, here we consider Anisosperma Silva Manso valid based on Nee et al. (Systematic Botany, 2009).
For Sicyoeae, here we follow Sebastian, P. et al. (Journal of Biogeography, 2012), who synonymized the following genera into Sicyos L., as listed in POWO on as of June 17, 2024: Parasycios Dieterle, Sicyosperma A. Gray, Sechiopsis Naudin, Sicyocaulis Wiggins, and Microsechium Naudin.
POWO on as of June 17 highlights Melothrianthus Mart. Crov. synonymized under Apodanthera Arn., but here we keep it distinct based on Lima, L.F.P. (Thesis, 2010).
For Luffa Mill., we followed the circumscription of Filipowicz (Systematic Botany, 2014), which recognizes 3 spp. so in the New World, and brings considerable differences with the POWO data on as of June 17, 2024.
Selysia Cogn., recognized in POWO with 4 spp., is here synonymized in Cayaponia Silva Manso, via Renner & Schaefer (Plant Genetics and Genomics: Crops and Models, 2016).
FAGALES
NOTHOFAGACEAE
For Nothofagaceae, we adopt here the classification by Heenan & Smissen (Phytotaxa, 2013), which divides the family into four genera: Trisyngyne Baill. (19, 5 in New Caledonia, 14 in New Guinea), Fuscospora (R.S.Hill & J.Read) Heenan & Smissen (1), Lophozonia Turczaninow (7), and Nothofagus Blume (6), the last three in South America. POWO on as of June 28, 2024 shows all genera under Nothofagus.
FAGACEAE
For Fagaceae in America Latina, we use Bartolomew & Almeda (Phytotaxa, 2023), which lists 145 spp. for the region, with Fagus L. and Trigonobalanus Forman having one species each, and 143 in Quercus. For the first two, both the work and POWO are in agreement. For Fagaceae of North America that do not occur in America Latina, we follow the numbers from POWO as of June 28, 2024, as follows: in Quercus L., there are a total of 91 spp. cited by POWO for the region, of which 37 are cited for Mexico, a number 5 units higher than that referred to in Bartolomew & Almeda (2023). Excluding these, there are 54 spp. remaining, which, added to the 143 Quercus from America Latina, total 197 spp. For the World, POWO cites a total of 469 spp. Excluding the 241 spp. cited for the Americas, and assuming there are no species in both hemispheres, there are 228 spp. exclusive to the Old World. Adding these 228 to the 197 validated here, we have 425 Quercus species in the world. In summary: 425 Quercus species in the World, 197 in the New World, 52 + 32 = 84 in North America excluding Mexico, 137 spp. in Mexico, 83 endemics, one in South America.
MYRICACEAE
Here, we accept the work of Huguet, V. et al. (Molecular Phylogenetics and Evolution, 2005), which divides Myrica L. into Myrica s.s. for M. hartwegii S. Watson (California) and M. gale L. (North America from Arctic to Virginia and Oregon, Spain to NW Russia, NE Russia to Japan in E Asia), and Morella L. for the others, including all species from Mexico to South America. In POWO on as of June 28, 2024, the two genera are listed under the name Myrica (SEE).
GERANIALES
GERANIACEAE
Accepted here the notes on the classification of Geranium L. (Geraniaceae) on Aedo, C. (BOOK, 2023).
MYRTALES
MELASTOMATACEAE
Although Bertolonia venezuelana Wurdack is recognized as valid by POWO on July 20, 2024 (SEE), we follow the position in LF. Bacci et al. (Botanical Journal of the Linnean Society, 2019) to reject the species in this genus and maintain it as endemic to Brazil.
POWO on July 20, 2024 highlights Loricalepis Brade as endemic to Brazil (SEE). Here we follow Goldenberg, R. et al. (Brittonia, 2020), which reports its occurrence also in Colombia.
POWO on July 24, 2024 recognizes Ossaea DC. with 5 species, 3 in the Caribbean and 2 in Brazil (SEE). Here we consider this genus to be synonymized under Miconia Ruiz & Pav. (Caddah, M.K. et al, Molecular Phylogenetics and Evolution, 2022).
Here we recognize the genus Rupestrea R.Goldenb., Almeda & Michelangeli as in R.Goldenb., Almeda & Michelangeli (Systematic Botany, 2015), which POWO on July 20, 2024 synonymizes under Miconia Ruiz & Pav. (SEE).
Here we consider 11 additional species not cited in POWO on as of June 10, 2024: Pleroma magdalenense (Brade) F. S. Mey. & R. Goldenb. (Brazil, 2023), Meriania urdialesii M.M.Jiménez, H.Garzón & Iturralde (Ecuador, 2024), Miconia dianae R.Goldenb., Michelang. & Amorim (Brazil, 2023), Microlicia arenaria R.Romero & Versiane, M. dentisepala R.Romero & Versiane, M. membranacea R.Romero & Versiane (Brazil, 2023), Marcetia barbadensis R.B.Pacifico & Almeda, M. minima R.B.Pacifico & Almeda, M. serratifolia R.B.Pacifico & Almeda (Brazil, 2023), Pleroma littorale F.S.Mey. & R.Goldenb. and P. semisterile F.S.Mey. & R.Goldenb. (Brazil, 2024).
MYRTACEAE
As of July 7, 2024, POWO does not recognize the genera Myrteola O.Berg (SEE) and Ugni Turcz. (SEE) as native to Brazil, but we consider both as native (both from Mount Neblina region) based on Reflora (SEE) and Reflora (SEE), respectively.
Here, we recognize the following species absent in POWO as of July 7, 2024: Eugenia guapiassuana T.Fern., M.T.C.Lacerda & J.M.A.Braga (Brazil, 2024), Eugenia lavradensis Tuler & Sobral (Brazil, 2024), Myrcia tenondeporan M.F.Santos & E.Barretto (Brazil, 2023), Campomanesia repanda O.Berg. (elevation rank, Brazil, 2021) and Eugenia rogersiana (Mattos) Parra-O (ex-Calycorectes rogersianus Mattos, Brazil, 2021).
Here, we account for the following inclusion absent in POWO as of July 7, 2024: Myrcianthes cavalcantei Mattos under M. fragrans (Sw.) McVaugh (Myrtaceae, BR, 2023, SEE).
ONAGRACEAE
We reject Hemifuchsia Herrera here, cited in POWO on as of June 26, 2024, as endemic to Peru (SEE).
VOCHYSIACEAE
Here we count the Brazilian endemic species Vochysia sobralii G.H.Shimizu & D.J.P.Gonç. (Phytotaxa, 2022), absent from the POWO list on as of June 21, 2024.
PICRAMNIALES
PICRAMNIACEAE
Here we consider three additional species not cited in POWO on as of June 10, 2024: Aenigmanu chococola Londoño-Ech. & A.M.Trujillo, Nothotalisia karsticola Londoño-Ech. & A.M.Trujillo and Picramnia vinacea Londoño-Ech. & A.M.Trujillo (Picramniaceae, CL, 2023).
SAPINDALES
ANACARDIACEAE
Here we consider one additional species not cited in POWO on July 08, 2024: Astronium woodii Villarroel & M.T.Martinez (Bolivia, 2021).
MELIACEAE
Here we consider five additional species not cited in POWO on as of June 26, 2024: Ruagea obovata T. D. Penn., R. beckii T. D. Penn., R. parvifructa T. D. Penn. (Ecuador to Bolivia, 2021), Carapa cedrotagua Londoño-Ech., A.M.Trujillo & Jiménez-Mont. (Colombia, 2024) and Cedrela gonzalopalominoi Villanueva & M. E. Morales (Colombia, 2023).
RUTACEAE
Here we consider the species Conchocarpus lilacinus (A.St.-Hil.) Bruniera & Groppo and C. limae (I.M.Silva) Bruniera & Groppo, cited in POWO on July 8, 2024, as synonymized under C. ruber (A.St.-Hil.) Bruniera & Groppo (SEE).
MALVALES
BIXACEAE
Moreira et al. (Economy Botany, 2015) consider Bixa orellana L. to be a form known only through cultivation.
MALVACEAE
POWO on January 21, 2025, expands Ayenia L. to include Rayleya Cristóbal and Byttneria Loefl. (SEE). Here, we follow Whitlock & Hale (Systematic Botany, 2011), maintaining Rayleya as a sister to Ayenia, including Byttneria.
We consider the designation of Dombeya Cav. for the Caribbean in POWO on January 21, 2025, to be an error (SEE).
Gossypium nobile Fryxell is cited for Brazil in POWO on January 21, 2025 (SEE), but this is a major error, as this species is Australian (Atlas of Living Australia/SEE).
Gossypium hirsutum L. is treated as native to Brazil in POWO on January 21, 2025 (SEE); however, we consider its occurrence in South America as non-native, restricting the species to the Caribbean and adjacent areas, based on Ning, W. et al. (Scientific Reports, 2024).
BRASSICALES
CARICACEAE
Here we recognize only Carica papaya L. in Carica L., with the other species listed in this genus by POWO as of June 20, 2024 (C. aprica V.M. Badillo and C. augusti Harms), being accepted here in Vasconcellea A. St-Hill., following the e-Monograph of the Caricaceae. By the same source and contrary to POWO, we do not consider Carica papaya as native to South America.
CAPPARACEAE
POWO on as of June 20, 2024 recognizes a very broad circumscription of Capparaceae around Morisonia Plum. ex L. (SEE), ignoring several works regarding the diversity of genera in the family in the New World. Here we adopt the circumscription of VPA on as of June 20, 2024 (SEE), including the considerations below.
Here we follow the POWO for the distribution of Colicodendron yco (Mart.) Mart. (under the name Morisonia yco (Mart.) Christenh. & Byng) as endemic to Brazil, contrary to the VPA, which highlights the occurrence of the species in Guyana (SEE).
Following Cornejo & Iltis (J.B.R.I. of Texas, 2008), we here recognize Colicodendron valerabellum H.H. Iltis, T. Ruiz & G.S. Bunting, a species endemic to Venezuela, absent from the VPA list (VER).
Even though it is a taxon from outside South America, here we follow Cornejo (Harvard Papers in Botany, 2020) in recognizing Acanthocapparis Cornejo as distinct from Capparicordis Cornejo & Iltis, which is thus restricted to South America with two species.
Here we consider the species Mesocapparis minutiflora Luber (endemic to Brazil, SEE), not cited in the VPA as of June 20, 2024.
CLEOMACEAE
POWO on as of June 20, 2024 recognizes a very broad circumscription of Cleomaceae around Cleome L. (SEE), ignoring several works regarding the diversity of genera in the family in the New World. Here we adopt the circumscription of VPA on as of June 20, 2024 (SEE), including the considerations below.
Here we adopt a broad circumscription of Cleomella L. as in POWO on as of June 20, 2024.
For Tarenaya Raf., here we follow Soares Neto et al. (Annals of the Missouri Botanical Garden, 2022); the work recognizes 38 species, one in Africa, 37 in the New World, 33 in South America, 22 in Brazil, 13 endemic. These data differ significantly from those still recognized in VPA, which also recognizes 14 Cleome L. in the New World.
For strictly South American Cleomaceae excluding Tarenaya, here we follow Roalson et al. (Phytotaxa, 2020/1) and Roalson et al. (Systematic Botany, 2020/2), in recognizing 10 genera in South America, 6 in Brazil, and 4 absent - the latters all in the Andean clade.
Here we follow Roalson et al. (Phytotaxa, 2020), and treat Mitostylis Raf. (America Central) nested within Physostemon Mart. & Zucc.
BRASSICACEAE
Here we include the Peruvian species Cardamine peruviana Al-Shehbaz & Marhold (Phytotaxa, 2023), absent from the POWO list on as of June 21, 2024.
SANTALALES
As of June 13, 2024, POWO considers Olacaceae s.l. (SEE). Here we follow MOBOT, which divides this family into 7 independent families (SEE), treated individually.
XIMENIACEAE
Here we count the record of Douradoa Sleumer in Venezuela and its exclusion from the list of endemic genera in Brazil (González & Aymard, Harvard Papers in Botany, 2023).
BALANOPHORACEAE
Here we record the occurrence of Lophophytum wedelii Hook. f. in Brazil, based on Cardozo (Checklist, 2015).
SANTALACEAE
As of June 13, 2024, POWO considers Santalum L. to be present in South America. However, here we regard the species in question, exclusive to Juan Fernandez Is., as belonging to Mida R.Cunn. ex A.Cunn, a genus reported as exclusive to New Zealand on the platform.
Thesium lopollense Hiern is erroneously reported as Bolivian, whereas it should be Botswana (SEE).
A notable revision, not followed here, of Phoradendron Nutt. and Dendrophthora Eichler for Brazil can be consulted in Dettke & Caires (Rodriguesia, 2021).
BERBERIDOPSIDALES
BERBERIDOPSIDACEAE
Here we report a new species, absent in POWO on as of June 10, 2024: Berberidopsis granitica Menegoz, A.E. Villarroel & Lavandero (Chile, 2024).
CARYOPHYLLALES
POLYGONACEAE
The situation of Polygonum L. in South America is chaotic, with various sources recognizing multiple confusing and ambiguous species, ranging from 18 to just 4. As of June 25, 2024, POWO highlights 4 species on the continent, including Polygonum brasiliense K.Koch, but does not list its distribution in Brazil, despite the epithet (SEE). Here, we will faithfully follow the reference, while highlighting the many inconsistencies regarding this genus.
POWO on as of June 25, 2024 lists Enneatypus Herzog as distinct from Ruprechtia C. A. Meyer; however, here we synonymize the former under the latter following Sánchez, A. & Kron, S. (Systematic Botany, 2011).
RHABDODENDRACEAE
Here we acknowledge the occurrence of Rhabdodendron amazonicum (Spruce ex Benth.) Huber in SE Colombia via Aymard et al. (Harvard Papers in Botany, 2016), a record absent in POWO as of June 26, 2024 (SEE).
CARYOPHYLLACEAE
Polycarpon Loefl. is not accepted in Brazil according to POWO on July 7, 2024 (SEE). Zuloaga et al. (Darwiniana, 2019) recognizes for southern Brazil the species Polycarpon apurense Kunth; however, Reflora does not recognize this genus natively in Brazil (SEE). Gereau e Marticorena (Novon, 1995) cites this species in Brazil. Here we accept the genus in Brazil, based on this reference, however as Polycarpon tetraphyllum subsp. apurense (Kunth) Iamonico & C.A.Zanotti, by POWO (SEE).
AMARANTHACEAE
POWO on July 7, 2024, lists Atriplex montevidense Spreng in Brazil (SEE), but we reject it due to the lack of support from other sources and even herbarium records.
Here we consider Pedersenia macrophylla (R.E. Fr.) Holub also in Brazil via Smithsonian (SEE), an occurrence not considered in POWO on July 7, 2024 (SEE).
AIZOACEAE
Here we include Sesuvium curassavicum Sukhor., a Caribbean species absent from POWO on as of June 25, 2024.
POWO on as of June 25, 2024, lists Trianthema portulacastrum L. as absent in Brazil; however, we accept the species in the country according to L. C. P. Lima et al. (Aizoaceae from Bahia/Journals UEFS, 2012).
NYCTAGINACEAE
For Bougainvillea Comm. ex Juss., here we follow Bautista et al. (PLANTS, 2022), which provides a very precise analysis of the genus, highlighting 11 species and their relationships and synonyms, besides POWO on as of June 25, 2024.
Here we include Neea campanulata D.S.Costa & E.F.S.Rossetto, endemic to Brazil, a species absent from POWO on as of June 25, 2024.
Via Rosseto et al. (Botanical Journal of the Linnean Society, 2019), here we consider Neea Ruiz & Pav. synonymized under Guapira Aubl., although most texts do not take this inclusion into account.
CACTACEAE
Here, contrary to POWO on November 26, 2024, we maintain Kimnachia S. Arias & N. Korotkova as a valid genus, distinct from Pseudorhipsalis Britton & Rose (Korotkova, N. et al, Phytotaxa, 2017).
Here we report a new species, absent in POWO on November 24, 2024: Tacinga paiaia J.G.Freitas & E.M.Almeida (BR, 2023), Cereus ingens, C. gerardi (BR, 2023),
CORNALES
LOASACEAE
Here we count a new species absent in POWO as of June 17, 2024: Nasa ojedae Cornejo & Weigend (Ecuador, 2024).
ERICALES
POLEMONIACEAE
We consider here the non-occurrence of one contoversial species listed in POWO on as of June 25, 2024: Cantua megapotamica Spreng. (SEE). Regarding this species, there is no exact information or concrete reference, so the position that Polemoniaceae does not occur natively in Brazil is maintained here.
LECYTHIDACEAE
Here we count the species Gustavia montana Cornejo, D. Gut. & J.S. Arango-G., absent in POWO as of June 25, 2024.
EBENACEAE
Here we count the species Lissocarpa bracki Vásquez & R. Rojas, endemic to Peru, absent in POWO as of June 25, 2024.
THEACEAE
Here we count the species Gordonia (Laplacea) plicata G. Moya, N. Miranda, Oleas & C. Ulloa, endemic to Ecuador, absent in POWO as of June 25, 2024.
SARRACENIACEAE
For Heliamphora Benth., there is much controversy regarding its diversity; due to the prestige and proposal, for the genus we follow Sarraceniaceae of South America (Wikipedia, 2011), which lists 23 species for the genus. H. neblinae Maguire is not listed as native to Brazil in the work, but according to Reflora (SEE), the species is considered Brazilian here; also according to Reflora (SEE), H. glabra Benth. is considered native to Brazil here, although the book states it is absent in the country.
ERICACEAE
Here we consider Oreanthes Benth. also in Peru based on Luteyn & Peñalosa (SEE). In POWO on July 14, 2024, this genus is treated as exclusive to Ecuador (SEE).
Here we consider an additional species in Brazil: Vaccinium chimantense Maguire, Steyerm. & Luteyn (Catalógo UCS), which is treated as a Venezuelan endemic in POWO as of July 14, 2024 (SEE).
GENTIANALES
RUBIACEAE
POWO, on January 21, 2025, does not recognize Chione DC. in Brazil (SEE), but here we accept this genus in the country based on Reflora (SEE).
GENTIANACEAE
POWO, as of November 8, 2024, considers Purdieanthus Gilg. as endemic to Colombia (SEE), a position here rejected based on P. Acevedo-Rodríguez (Gentian Climbers).
Here, we consider the record of Voyria alvesiana E.F.Guim., T.S.Mendes & N.G.Silva in French Guiana and Suriname (Gomes et al., Taxon, 2022), which is still absent in POWO as of November 8, 2024 (SEE).
APOCYNACEAE
Manothrix Miers is tentatively assigned to Gonolobiinae, based solely on the text box of its Wikipedia page (SEE), despite its original description (SEE).
Here, we accept Echites P. Browne in South America from the Colombian Caribbean islands, a citation absent in the map of POWO as of January 21, 2025 (SEE).
Kerbera E. Fourn. and Schistonema Schltr. are tentatively placed in Oxypetalinae here, based on Rapini et al. (Phytotaxa, 2011).
SOLANALES
CONVOLVULACEAE
Here we consider Cressa L. native to Brazil via Reflora (SEE), despite POWO on July 7, 2024, not considering this genus in Brazil (SEE).
Here we follow Staples & Simões (Botanical Journal of the Linnean Society, 2017), in considering Merremia L. an Old World exclusive genus; thus, the 4 species that POWO on July 7 cites for the New World are here moved to Distimake Raf.
Here, we recognize the following species absent in POWO as of July 7, 2024: Ipomoea bonsai D. Santos & Alencar (Brazil, 2020) and Jacquemontia ferricola Belo, Buril & Louzada (Brazil, 2023).
Here, we account for the following inclusion absent in POWO as of July 7, 2024: Evolvulus linarioides Meisn. under Evolvulus saxifragus Mart. (Brazil, 2022), and Cuscuta orbiculata Yunck under Cuscuta tinctoria Mart. (Brazil, 2021).
SOLANACEAE
Here we consider one additional species not cited in POWO on July 13, 2024: Metternichia macrocalyx (Carvalho) L.S.Souza & Stehmann (Brazil, 2023),
For Nolana L. on July 13, 2024, we followed Dillon (Harvard Papers in Botany, 2023), which lists 92 spp.: 42 from Peru, 46 from Chile, three in both Peru and Chile, and one species in the Galapagos Islands, Ecuador.
Deprea Raf., cited in Brazil by POWO in July 14, 2024 (SEE), but rejected in Brazil by Reflora (SEE).
POWO on July 14, 2024 highlights Datura L. as native to Colombia (SEE), but here it is rejected based on the Catalog of Plants and Lichens of Colombia (site unavailable).
POWO on July 14, 2024 does not recognize Protoschwenkia Soler. in Brazil (SEE), but here we consider it native based on Reflora (SEE).
Brugmansia Pers. deserves mention for not having any consensus on its real diversity. The VPA recognizes 8 species with disputable distributions (SEE), and none in Brazil, highlighting B. suaveolens (Humb. & Bonpl. ex Willd.) Sweet as native to Peru and the Caribbean. IUCN recognizes 7 spp. (SEE) and lists one as endemic to Brazil (B. suaveolens) and one shared (B. insignis (Barb.Rodr.) Lockwood ex R.E.Schult.). Reflora lists two spp. in Brazil, both non-native (SEE), with B. suaveolens declared as native to Mexico, America Central, and northern South America. The IUCN is quite consistent but diverge from Dupin & Smith (Taxon, 2018), which presents a very simplistic view giving 5 species for this genus, 3 from the Andes and two from the lowlands of South America, with B. suaveolens declared as Amazonian, but in the previous references, this position belongs to B. insignis. Here we consider the seven species recognized by POWO (SEE), including the five from Dupin & Smith, retaining B. versicolor Lagerh. (endemic to Ecuador), B. aurea Lagerh. (Colombia and Ecuador), B. arborea (L.) Sweet (Ecuador to Chile and Bolivia), and B. sanguinea (Ruiz & Pav.) D. Don (Colombia to Chile and Bolivia), and adding B. vulcanicola (A.S. Barclay) R.E. Schult. from the Andes of Colombia and Ecuador, and B. insignis (Colombia to Bolivia and N Brazil), which corresponds to the Amazonian populations of B. suaveolens, thus making the latter species endemic to the eastern coast of Brazil.
POWO on July 14, 2024 recognizes Nectouxia Kunth (1, Texas to Mexico); here we accepted this genus under Salpichroa Miers, by Carrizo García, C. et al (Plant Systematics and Evolution, 2018).
BORAGINALES
For Boraginales, we follow the APWeb here, which divides the order into 8 families (SEE). However, POWO on as of June 19, 2024 (SEE), and Angios Bergianska (SEE) considered all of them as just Boraginaceae, and VPA considered a mix of confusing and incorrect inclusions.
HYDROPHYLLACEAE
Although Phacelia Juss. is not listed as native to Brazil by Reflora (SEE) or VPA (SEE), here we follow POWO as of June 19, 2024, which highlights a species native to Brazil (SEE), a position reinforced by own Reflora/Herbario Virtual (SEE), Vasile, M.A. et al (Taxon, 2024) and Flora Argentina (SEE).
HELIOTROPIACEAE
Via Luebert, Hilger, and Weigend (Mol. Phyl. and Evolution, 2011) and Boraginales Working Group (Researchgate, 2016), the SSAA recognizes Tournefortia L. as merged into Heliotropium L., different from POWO as of June 19, 2024, which keeps it independent.
LAMIALES
OLEACEAE
POWO on as of June 24, 2024, does not recognize Menodora Bonpl. in Brazil (SEE), but here we consider it via Reflora (SEE).
PELTANTHERACEAE
POWO on as of June 24, 2024, considers Peltanthera Benth. in Gesneriaceae (SEE), but here we follow APWeb, which emancipates the genus in the monotypic Peltantheraceae (SEE).
CALCEOLARIACEAE
With profound inconsistency, Calceolariaceae is not cited for Brazil by either VPA or POWO on as of June 24, 2024 (SEE), and the only species cited for Brazil is considered 'naturalized' by Reflora (SEE); here we fully accept the family in Brazil as per Souza & Giulietii (BOTÂNICA, 2009).
GESNERIACEAE
Vanhouttea Lem. and Paliavana are cited in POWO on July 8, 2024 (SEE), but here we follow Perret et al. (American Journal of Botany, 2003), which suggests merging the two into Sinningia Nees.
POWO on as of June 24, 2024, considers Peltanthera Benth. in Gesneriaceae (SEE), but here we follow APW, which emancipates the genus in the monotypic Peltantheraceae (SEE).
POWO on July 8, 2024, distributes Tylopsacas Leeuwenb. only to Venezuela and Guyana (SEE), but here we also treat it as occurring in Brazil, based on Reflora (SEE).
POWO on as of June 24, 2024, describes Cubitanthus Barringer in Gesneriaceae (SEE). Here we follow S. Santos A. et al. (Molecular Phylogenetics and Evolution, 2023) which placed Cubitanthus within Linderniaceae.
Here we consider one additional species not cited in POWO on July 08, 2024: Pachycaulos huancabambae J.L.Clark & Moonlight (Peru, 2023).
POWO on July 8, 2024, marks Gloxinella Roalson & Boggan as endemic to Colombia (SEE). However, here we follow Araújo, A.O. et al. (Acta Botanica Brasilica, 2012), which indicates that it is not endemic to Colombia. Due to alleged collections in northern Peru, we prefer to highlight it as endemic to this country.
For Mandirola Decne, we follow Reflora (SEE) here, which recognizes only three species, all exclusively Brazilian and absent in Bolivia as suggested by POWO on July 8, 2024 (SEE).
PLANTAGINACEAE
Here we consider one additional species not cited in POWO on July 08, 2024: Philcoxia cachimboensis Scatigna & Lopes-Neto (Brazil, 2023).
Benjaminia Mart. ex Benj., cited in POWO on July 8, 2024 (SEE), is treated here as Bacopa Aubl., based on A. V. Scatigna et al. (Botanical Journal of the Linnean Society, 2022).
LINDERNIACEAE
POWO on as of June 24, 2024, describes the genus Ameroglossum Eb. Fisch., S. Vogel & A.V. Lopes as in Schophulariaceae (SEE), Cubitanthus Barringer in Gesneriaceae (SEE), Isabelcristinia L.P. Félix, Christenh. & E.M. Almeida and Catimbaua L.P. Félix, Christenh. & E.M. Almeida as in Linderniaceae (SEE). Here we follow S. Santos A. et al. (Molecular Phylogenetics and Evolution, 2023) which synonymizes the latter two within Ameroglossum, and placed with Cubitanthus within Linderniaceae.
VERBENACEAE
For Casselia Nees & Mart., we follow Cardoso, P.H. (Acta Botanica Brasilica, 2024), which recognizes 8 spp. POWO, on July 8, 2024, recognizes only 7 (SEE).
Here we reject Pitraea Turcz. in Brazil via Reflora (SEE), a genus indicated as Brazilian in POWO on July 8, 2024 (SEE).
Here we consider two additional species not cited in POWO on July 08, 2024: Stachytarpheta meninii P.H. Cardoso (Brazil, 2023), S. liviae P.H. Cardoso & Salimena (Brazil, 2024).
Here, we account for the following inclusion absent in POWO as of July 08, 2024: Stachytarpheta viscidula Schauer under S. commutata Schauer (Verbenaceae, BR, 2023).
ACANTHACEAE
Dianthera L. (41, New World, 24 in South America, 15 in Brazil, 7 endemics, now in Justicia), Xantheranthemum Lindau (1, Peru, now in Aphelandra), Stachyacanthus Nees. (1, Brazil, now in Ruellia), Cuenotia Rizzini (1, Brazil, now in Aphelandra), Liberatia Rizzini (2, Brazil and Bolivia one each, now in Lepidaganthis), Morsacanthus Rizzini (1, Brazil, now in Pseuderanthemum) and Polylychnis Bremek (1, now in Ruellia), cited in POWO on July 13, 2024 (SEE), are here rejected via Tripp et al. (Taxon, 2021).
Here we follow Cornejo (Harvard Papers in Botany, 2020) and recognize all New World species of Avicennia L. in POWO on July 13, 2024 under Hilairanthus Tiegh.
Here we consider Aphanandrium Lindau as a valid name for the Neriacanthus Benth. & Hook.f. of South America, as it is a name absent in Tripp et al. (Taxon, 2021)
Here, the species of Anisacanthus Nees still recorded for South America (A. brasiliensis Lindau) is placed under Thyrsacanthus Moric, based on Chagas, E.C.O. and Costa-Lima, J.M. (Phytotaxa, 2022).
LAMIACEAE
Here we consider one additional species not cited in POWO on July 13, 2024: Oocephalus viscaria Harley & J.F.B.Pastore (Brazil, 2021).
OROBANCHACEAE
Via Souza & Giulietti (Thesis, 2009), Anisantherina Pennell, still cited in POWO on July 13, 2024 (SEE), is here taken under Agalinis Raf.
Via Schneider (PhytoKeys, 2016), all species of Orobanche L. of the New World, still cited in POWO on July 13, 2024 (SEE), are here taken under Aphyllon Mitch.
ASTERALES
CAMPANULACEAE
Despites POWO on as of June 10, 2024, Burmeistera Karst. & Triana is accepted in Brazil, due to collections in the Monte Neblina region (Catalogo UCS).
Here we accepted Burmeistera luciae Zapata-Corr., Garzón & Ruiz-Mol. (Colombia, 2024), absent in POWO on as of June 11, 2024
ASTERACEAE
As of January 21, 2025, POWO does not recognize the genera Microgyne Cass., Jaumea Pers., Berroa Beauverd, and Helenium L. as occurring in Brazil. However, we follow Reflora (SEE), in which all these genera are recognized as valid and native to the country.
POWO, on January 21, 2025, recognizes Chucoa Cabrera as a valid genus, but here we consider it a synonym of Onoseris Willd., based on Panero (Phytologia, 2009).
Although POWO, on January 20, 2025, lists two species of Gochnatia D. Don in Brazil (SEE), it is considered absent from the country according to Robinson & Funk (PhytoKeys, 2020).
Harpalyce D. Don (not the Harpalyce Moc. & Sessé ex DC. from Fabaceae) is confusingly stated in POWO as of January 21, 2025, being announced as a synonym of Nabalus Cass. (SEE), yet still listed with two species. Here, we completely reject it.
Additionally, as of January 21, 2025, POWO does not recognize two species of Liabum in Brazil, but we acknowledge them here based on Moreira & Oliveira (Book Chapter, 2017).
Although POWO, as of January 21, 2025, recognizes two species of Eremosis (DC.) Gleason in South America—one as a disjunction between Mexico and Ecuador and the other between Mexico and Brazil (SEE), the lack of complementary information is significant. Therefore, we choose to exclude the genus entirely from the continent.
Here we consider in Brazil the new genus Roquea Loeuille & Antar, endemic to the country, still absent from POWO as of January 21, 2025 (SEE).
For the complex genus Vernonia L., we completely reject the broad and global circumscription of the genus and follow H. Robinson & V.A. Funk (PhytoKeys, 2018), which restricts the genus to North and South America.
POWO, on January 21, 2021, recognizes Robinsonia DC. (endemic to Chile), but here we consider it within Senecio, based on Suk Cho et al. (BMC Plant Biology, 2024).
Here, we consider Belloa J. Rémy to be restricted to B. chilensis J. Rémy (Chile to Argentina), with the other four species of the genus listed in POWO on January 21, 2025, being placed in Mniodes (A. Gray) Benth., following Freire, S.E. et al. (Plant Systematics and Evolution, 2014).
POWO, on January 21, 2025, recognizes Pseudobaccharis Cabrera as distinct from Baccharis L., but here we consider it a synonym, based on Heiden G. (Thesis, 2014).
POWO, on January 21, 2025, recognizes Lemmatium DC. as a valid genus (endemic to Brazil), but here we consider it a synonym of Calea L., based on Urbatsch et al. (Systematic Botany, 1986).
Oyedaea DC. is cited in POWO as of January 21, 2025, with two species in Brazil (SEE). However, we reject this genus here, considering these species under Aspilia L. (SEE) and Dimerostemma Cass. (SEE).
Unlike POWO on January 21, 2025, Pascalia Ortega is recognized here as native to Brazil, following Crespo & Pena-Martín (Phytotaxa, 2014).
APIALES
ARALIACEAE
Here we recognize Hydrocotyle alpina Vell., elevated to species by Nery, E.K. et al. (Plant Systematics and Evolution, 2020), but unfortunately unrecognized in POWO as of June 11, 2024.
APIACEAE
Here we count Ammoselinum Torr. & A. Gray as Brazilian, based on Reflora (SEE).
Although POWO on as of June 13 considers Anthriscus Pers. and Cryptotaenia DC. in South America, for Argentina and Peru, respectively, we reject these two occurrences here.
ANNEX 3: UPDATES MADE AFTER THE DATE OF THE GENERAL REVIEW
Update on Apodanthaceae, with its merger with Rafflesiaceae and placement in Malpighiales,by Alzate J.F. et al. (Molecular Phylogenetics and Evolution, 2024).
ANNEX 4: PUBLICATIONS THAT HAVE NOT YET BEEN REVIEWED BY SSAA
WORKS IN MORPHOLOGY
Characterizing the Frequency, Morphological Gradient, and Distribution of Dioecy in Miconia (Melastomataceae, SEE ).
WORKS IN PHYLOGENY
Progress in systematics and biogeography of Orchidaceae
Revalidación de especies del complejo Oxalis laxa (sección Alpinae, Oxalidaceae) que crecen en Chile
Synopsis of Argythamnia, Chiropetalum and Philyra (Euphorbiaceae) in South America
A huge confusion in Psittacanthinae
Towards a species-level phylogeny for Neotropical Myrtaceae: Notes on topology and resources for future studies
Molecular phylogeny of bladderworts: A wide approach of Utricularia (Lentibulariaceae) species relationships based on six plastidial and nuclear DNA sequences
GENUS LEVEL REVISIONS OR PHYLOGENY
Besleria (Gesneriaceae, SEE), Orthosia (Apocynaceae, SEE), Gamochaeta (Asteraceae, SEE).
SINONIMIZATIONS OF GENERA
Colanthelia under Aulonemia (Poaceae, SEE), Brachistus under Witheringia (Solanaceae, SEE), Esterrhazya under Agalinis (Orobanchaceae, SEE), Thamnoseris under Dendroseris (Asteraceae, SEE, both genera accepted here in Sonchus).
DOWN STATUS FOR SPECIES
Caliandra medelinnesis as a hybrid (SEE)
Parinari leonthopitheci down (Chrysobalanaceae, SEE).
SINONIMIZATIONS OF SPECIES
Maxillaria sibundoyensis under M. floribunda (Orchidaceae, SEE), Salvia articulata under S. sellowiana and S. itatiaiensis under S. arenaria (Lamiaceae, SEE), Pentacalia viburnifolia, P. brittoniana, P. miguelii under P. psidiifolia (Asteraceae, BL, 2021), Stevia breviaristata under S. vaga (Asteraceae, AR, 2021).
SIMPLE RENAMES
Catasetum meeae as C. lendarium (Orchidaceae, SEE), Camptosema praeandinum as Cerradicola praeandina (Fabaceae, BL/AR, 2021, SEE), Tovomita aequatoriensis as Clusia aequatoriensis (Clusiaceae, SEE), Pachira dolichocalyx under P. macrocalyx (SEE), Pachira nitida under P. minor (SEE), Cremolobus linearifolius as Menonvillea linarifolia (Brassicaceae, SEE) and Justicia comata as Spigelia beccabungoides (Loganiaceae to Acanthaceae, UR or PAR, 2001, SEE)
ELEVATION RANK OR EMANCIPATION AT GENERIC LEVEL
Anisantherina off Agalinis (Orobanchaceae, SEE).
ELEVATION RANK AT SPECIES LEVEL
Inga luschnathiana (Fabaceae, BR, 2022, SEE), Senna schultesiana (H.S.Irwin & Barneby) A.G.Lima & Mansano (Fabaceae, SEE) and Parinari pohlii Hook.f. (Chrysobalanaceae, SEE).
NATIONAL CHECKLISTS
Dryadella in Brazil (Orchidaceae, SEE), Bidens in Bolivia (Asteraceae, SEE) and Dendrophorbium in Peru (Asteraceae, SEE).
NEW NATIONAL RECORDS
Triphora surinamensis (Orchidaceae, new in CL, SEE), Anadenanthera colubrina (Fabaceae, new in Argentina, SEE), Mimosa asperoides (Fabaceae, new in BR, 2023, formerly in Uruguay, SEE), Myrcianthes prodigiosa (Myrtaceae, new in CL, SEE), Pycnophyllum macropetalum (Caryophyllaceae, new in Argentina, SEE), Gloxinia major (Gesneriaceae, new in Argentina, SEE), and Utricularia amesthytina (Lentibulariacae, excluded in MX/BLZ, now only BR/VZ, 2021, SEE).
NEW SPECIES
100 new species, being 0 ENDEMICS among countries: Brazil (0), Colombia (0), Peru (0), Ecuador (0), Bolivia (0), Venezuela (0), Chile (0), Guianas (0), Argentina (0), Suriname (0); and 6 NON ENDEMICS: as BR/VZ(0)⋅ BR/EC(0) ⋅ BR/AR(0) ⋅ BR/BL(0) ⋅ BR/CL (0) ⋅ BR/GU´s (0) ⋅ AR/BL (0) ⋅ AR/UR(0) ⋅ AR/PAR(0) ⋅ CL/PAN(0) ⋅ CL/VZ(0) ⋅ CL/EC(0) ⋅ CL/PR(0) ⋅ PR/BL(0) ⋅ EC/PR (0) ⋅ PR/CH(0) ⋅ CL/EC/PR(0) ⋅ AR/PAR/CH(0) ⋅ BR/BL/PAR(0) ⋅ ⋅ VZ/GU/SR(0) ⋅ BR/BL/PAR(0) ⋅ EC/PR/BR(0)
AMBORELLANAE, NYMPHAEANAE, AUSTROBAYLEANAE, CHLORANTHANAE, MAGNOLIANAE
Duguetia rolimii (Annonaceae, BR, 2024), Aiouea myrmecophila (Lauraceae, BR, 2024), Andea ferruginea, Ocotea pterocaulis (Lauraceae, EC, 2024), Persea quarticicola (Lauraceae, BR, 2024), Persea sp. (Lauraceae, EC, 204), Peperomia ilheusensis, P. itaimbense, P. mendanhensis (Piperaceae, BR, 2024), Piper globirhachis (Piperaceae, PR, 2024), Peperomia dryadica (Piperaceae, BR, 2024).
LILIANAE
Aemulanthus R.P. Oliveira & F.M. Ferreira (Poaceae, 2024. Only one sp., A. decumbens R.P. Oliveira & F.M. Ferreira, endemic to Espírito Santo state, E Brazil. Spiciform synflorescences on decumbent culms composed of monomorphic gynaecandrous whorls.), Quixiume (Poaceae, BR, 2024, off Aulonemia), Stelanemia (Poaceae, BR, 2024, off Aulonemia), Vianaea (Poaceae, BR, 2024, off Aulonemia), A. caquetense, A. florenciense, A. marcocorreae (Araceae, CL, 2024), Anthurium sp. (Araceae, EC, 2024), Xanthosoma camiloi (Araceae, CL, 2024), Alstroemeria maranhensis (Alstroemeriaceae, BR, 2024), Hieronymiella peruviana (Amaryllidaceae, PR, 2024), Cattleya attenboroughiana (Orchidaceae, BR, 2024), Catasetum cantuariae (Orchidaceae, BR, 2024), Lepanthes chalalensis (Orchidaceae, CL, 2024), Epidendrum pembertonii (Orchidaceae, CL, 2024), Lepanthes pseudoabitaguae (Orchidaceae, CL, 2024), Lepanthes dianatrujilloana, L. dianauribeana, L. gloriagaleanoana, L. laurarestrepoana, L. margaritamarinoana, L. nidiagongorana, L. nubiamuñozana, L. paolaalzateana (Orchidaceae, CL, 2023), Lepanthes attenboroughii (Orchidaceae, CL, 2022), Pleurothallis falcata (Orchidaceae, CL, 2024), Malaxis engelsii (Orchidaceae, BR, 2024), Maxillaria andina (Orchidaceae, CL, 2024), Malaxis susanae (Orchidaceae, CL, 2024), Brachystele morronei (Orchidaceae, AR, 2023), Malaxis ybytus (Orchidaceae, BR, 2023), Kefersteinia sp. (Orchidaceae, CL, 2023), Catasetum queirozii (Orchidaceae, BR, 2024), Telipogon mariae-luisae (Orchidaceae, PR, 2023), Octomeria jimenezii (Orchidaceae, EC, 2024), Campylocentrum luzmariae (Orchidaceae, CL, 2024), Vanilla cameroniana (Orchidaceae, FG, 2023), Pelexia [Pachygenium] muyscarum (Orchidaceae, CL, 2023), Telipogon mariae-luisae (Orchidaceae, PR, 2023), Cyrtopodium valebellae (Orchidaceae, BL, 2023), Pelexia [Pachygenium] laurense (Orchidaceae, AR, 2022), Pityphyllum [Maxillaria] mercedes-abarcae (Orchidaceae, EC, 2021), Pseudolepanthes bihuae (Orchidaceae, EC, 2021), Telipogon sp. (Orchidaceae, EC, 2021), Paepalanthus fonsecai (Eriocaulaceae, BR, 2024), Eremitis pernambucensis (Poaceae, BR, 2024), Guadua bambuzoniae (Poaceae, CL, 2024) and Chusquea cordata (Poaceae, BR, 2023).
CERATOPHYLLANAE, RANUNCULANAE, PROTEANAE, TROCHODENDRANAE, BUXANAE, MYROTHAMNANAE, DILLENIANAE, SAXIFRAGANAE, VITANAE
Doliocarpus daironi (Dilleniaceae, CL, 2024).
ROSANAE
Cabari Gregório & D.B.O.S.Cardoso (Fabaceae. Trees, large, with imparipinnately compound leaves and opposite leaflets, inflorescences terminal or less often axillary, woody pods with elastically dehiscent valves, and large seeds. 4 spp. from northern South America, two in Brazil, none endemics/SEE), Incacleome Cornejo gen. nov. (Cleomaceae, segregated from Andinocleome, 3 spp., Pacific coastal 'lomas' (fog deserts) to ca. 3200 m in the high Andes of Chile to N Peru (Dept. Amazonas) in the central Andean block), Oxalis amicorum, O. paramnoensis (Oxalidaceae, VZ, 2024), Lorostemon roseoviridis (Clusiaceae, BR/GU, 2024), Janusia longibracteolata (Malpighiaceae, BR, 2024), Carolus tomentosus (Malpighiaceae, BR, 2023). Malesherbia anxia (Passifloraceae, PR, 2024), Chrysobalanus atlanticus (Chrysobalanaceae, BR, 2024), Neosprucea chrysantha (Salicaceae, CL, 2024), Phyllanthus gandarelensis (Phyllanthaceae, BR, 2024), Securidaca aurea (Polygalaceae, BR, 2024), Senega calcarata, S. carautana, S. cordeiroi, S. filiformis, S. longiflora (Polygalaceae, BR, 2024), Senega [Polygala] bringelii, Senega [P.] tocantinensis (Polygalaceae, BR, 2021), Senega [Polygala] petricola (Polygalaceae, BR, 2022), Collaea caerulea (Fabaceae, BR, 2024), Mimosa cardosoi, M. simonii (Fabaceae, BR, 2023), Senna yungas (Fabaceae, BL, 2024), Senna manaosana (Fabaceae, BR, 2024), Ampelocera percyhernandezii (Ulmaceae, CL, 2024), Eugenia stenocarpa (Myrtaceae, BR, 2024), Siphoneugena carolynae (Myrtaceae, BR, 2024), Campomanesia lorenziana (Myrtaceae, BR, 2024), Microlicia campostriniae, M. subtilis (Melastomataceae, BR, 2024), Zanthoxylum planaltense (Rutaceae, BR, 2024), Vasconcellea jossei (Caricaceae, EC, 2024), Quararibea centinelae (Malvaceae, EC, 2024), Theobroma globosum, T. nervosum, T. schultesii (Malvaceae, CL(2), EC(2,3), PR(1,3), BR(1), 2024), Byttneria filifolia (Malvaceae, BR, 2024), Ceiba camba (Malvaceae, BR/BL, 2024).
CARYOPHYLANAE
Coleocephalocereus superbus (Cactaceae, BR, 2024), Arrojadoa luetzelburgioides (Cactaceae, BR, 2024), Tacinga mirim (Cactaceae, BR, 2024).
ASTERANAE
Chytroma Miers (Lecythidaceae, 18 spp., Panama to tropical America, 16 in Brazil, some endemic), Guaiania O.M.Vargas & C.W.Dick (Lecythidaceae, 5 spp., northern South America, 4 in Brazil), Imbiriba O.M.Vargas, M. Ribeiro, & C.W.Dick (Lecythidaceae, 8 spp., all endemic to the Brazilian Atlantic Forest with exception of I. nana which occurs in the Cerrado), Pachylecythis Ledoux (Lecythidaceae, 5 spp., Nicaragua to Brazil, all in South America; 3 spp. in Brazil, two endemics), Scottmoria Cornejo (Lecythidaceae, 23 spp.), Waimiria C.W.Dick & O.M.Vargas (Lecythidaceae, a single species, W. amazoniciformis (S.A.Mori) C.W.Dick & O.M.Vargas, now only from Amazonas state in N Brazil), Leonoria (Rubiaceae. Only one sp., L. calcicola (R.M.Salas & E.L.Cabral) Nuñez Florentin & R.M.Salas, from in seasonally dry region inside the dry seasonal scrubland of NE Brazil (caatinga) biome of Bahia state Brazil), Xiphodesma Pozner & Zijlstra (Calyceraceae, Argentina and Uruguay, for Boopis anthemoides Juss.), Freziera antioquensis (Pentaphylacaceae, CL, 2024), Ternstroemia pacifica, T. fandango, T. cachalu, T. religiosa (Pentaphylacaceae, CL, 2024), Myriopus gleissonii (Heliotropiaceae, CL, 2023), Varronia elsieae (Cordiaceae, BR, 2023), Gentianella campaniflora, G. potosiana, G. pringlei, G. puberula, G. samae. (Gentianaceae, BL, 2024), Notopleura aurantiaca, N. bracteata, N. cajamarcana, N. divaricata, N. harlingii, N. kosnipatana, N. valenzuelae, N. stevensonii (Rubiaceae, EC, PR, BR | PR | PR | CL | EC | PR | PR | CL, 2024), Evolvulus jalapensis (Convolvulaceae, BR, 2024), Columnea conopurpurea (Gesneriaceae, CL, 2024), Drymonia cutervoensis (Gesneriaceae, PR, 2024), Drymonia tomentosa (Gesneriaceae, CL, 2024), Fridericia caudata (Bignoniaceae, BR, 2024), Eplingiella sanoi (Lamiaceae, BR, 2024), Aphelandra guacharorum, A. montis-tusae, Justicia betancurii, J. chloroleuca, J. cristalina, J. daironcardenasii, J. ipanorensis, J. lutescens, J. macuirensis, J. perijaensis, J. reniformis, J. rheophytica, J. santanderana, Ruellia rheophytica (Acanthaceae, CL, 2024), Stachytarpheta eimeariae, S. praetermissa (Verbenaceae, BR, 2024), Oritrophium acerosum (Asteraceae, EC, 2024), Isocarpha spathulata (Asteraceae, BL, 2023), Lepidaploa nakajimae (Asteraceae, BR, 2024), Porophyllum iruyense (Asteraceae, AR, 2024), Haplopappus colliguayensis, H. teillieri (Asteraceae, CH, 2023), Praxelis cleggiae (Asteraceae, BL, 2024), Eryngium cerradense (Apiaceae, PAR, 2023), Eryngium absconditum (Apiaceae, PAR, 2022).
SINGLE-SPECIES WORK
Alstroemeria maxima (Phil.) N.I.Villalobos & C.M.Baeza (Alstroemeriaceae, integrative taxonomy).
Sambucus australis Cham. & Schltdl. ('sauco', a wild and native species from South America: a review for its valorization as a wild food plant with edible and medicinal properties).
Crassula peduncularis (Sm.) Meigen (conservation in Brazil).
OTHER WORKS AND NOTES
SYNOPSIS OF SOUTH AMERICAN ANGIOSPERMS
IKK SÃO PAULO
UPDATED IN JANUARY 21, 2025